题目内容
9.如图1是硫酸试剂瓶标签上的内容.
实验室用该硫酸配制240mL0.46mol•L-1的稀硫酸,则
(1)需要该硫酸的体积为6.3mL;
(2)有以下仪器:
A.烧杯B.100mL量筒C.250mL容量瓶 D.500mL容量瓶
E.玻璃棒F.托盘天平(带砝码)G.10mL量筒H.胶头滴管,
配制时,必须使用的仪器有A C E G H(填代号);
(3)配制过程中有几个关键的步骤和操作如图2所示:将上述实验步骤A-F按实验过程先后次序排列C B D F A E.
(4)该同学配制得到溶液经标定后发现实际浓度为0.45mol•L-1,可能的原因是CD
A.量取浓H2SO4时仰视刻度
B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶
D.定容时仰视刻度.
分析 (1)根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)依据配制一定物质的量浓度溶液时的一般步骤选择需要仪器;
(3)依据配制一定物质的量浓度溶液时的一般步骤排序;
(4)根据c=$\frac{n}{V}$进行误差分析,凡是引起n偏小或者V偏大的操作,所配溶液的浓度将会偏小;凡是引起n偏大或者V偏小的操作,所配溶液的浓度将会偏大.
解答 解:(1)浓H2SO4的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,配制240mL溶液需要选择250mL容量瓶,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×0.46mol/L,解得:x≈6.3mL;
故答案为:6.3ml;
(2)配制一定物质的量浓度溶液时的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,
用到的仪器:量筒、玻璃棒、烧杯、胶头滴管、250mL容量瓶,量取6.3mL浓硫酸需要选择10mL量筒,
故选:A C E G H;
(3)配制一定物质的量浓度溶液时的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的步骤为:C B D F A E;
故答案为:C B D F A E;
(4)A.量取浓H2SO4时仰视刻度,导致量取的浓硫酸的体积偏大,硫酸的物质的量偏大,浓度偏高,故A不徐娜;
B.容量瓶洗净后未经干燥处理,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B不选;
C.没有将洗涤液转入容量瓶,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故C选;
D.定容时仰视刻度,导致溶液体积偏大,溶液浓度偏低,故D选;
故选:C D.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制过程及操作步骤是解题关键,注意容量瓶、量筒规格的选择,注意误差分析的方法和技巧,题目难度不大.

 阶梯计算系列答案
阶梯计算系列答案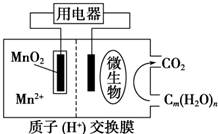
| A. | 正极反应式为MnO2+4H++2e-═Mn2++2H2O | |
| B. | 微生物所在电极区放电时发生还原反应 | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若用该电池给铅蓄电池充电,MnO2 电极质量减少8.7g,则铅蓄电池阴极增重9.6g |

| A. | X的一个分子中有32个氢原子 | B. | X的一个分子中含有三个 | ||
| C. | X是一种醇 | D. | X不能使溴的CCl4溶液褪色 |
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为CO32->SO32->CH3COO->HSO3-.
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是B.
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是A.
A.c(CH3COO-)>c(HCO3-)>c(OH-) B.c(Na+)+c(H+)=c(CH3COO-)+c(HCO3-)+c(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-) D.c(CH3COO-)+c(CH3COOH)=c(HCO3-)+c(CO32-)
| A. | 温度 | B. | 催化剂 | C. | 反应物浓度 | D. | 压强 |
