题目内容
4.只用氢氧化钠溶液不能除去下列各组物质中的杂质(括号中是杂质)的是( )| A. | Mg(OH)2( Al(OH)3) | B. | MgCl2(AlCl3) | C. | Mg(Al) | D. | MgO(Al2O3) |
分析 均与NaOH溶液反应的混合物,不能只利用NaOH溶液除杂,结合氢氧化铝、氧化铝的两性来解答.
解答 解:A.只有Al(OH)3与NaOH反应,则只用氢氧化钠溶液能除杂,故A不选;
B.二者均与NaOH溶液反应,只用NaOH不能除杂,故B选;
C.只有Al与NaOH反应,则只用氢氧化钠溶液能除杂,故C不选;
D.只有Al2O3与NaOH反应,则只用氢氧化钠溶液能除杂,故D不选;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意Al及其化合物的性质及应用,题目难度不大.

练习册系列答案
相关题目
14.下列叙述或实验现象描述正确的是( )
| A. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 | |
| B. | 往足量铁与稀硝酸反应后的溶液中滴入KSCN溶液,溶液变为血红色 | |
| C. | 往FeSO4溶液中通入NO2气体,溶液始终无明显现象 | |
| D. | 往BaCl2溶液中通入SO2气体,无沉淀产生,再通NH3,产生白色沉淀 |
15.运用元素周期律分析,下列说法错误的是( )
| A. | Ra是第七周期ⅡA族的元素,Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | I是第五周期ⅦA族的元素,HI的还原性比HCl的还原性弱 | |
| C. | Cs的原子半径比Na的原子半径大,Cs与水反应比Na与水反应更剧烈 | |
| D. | S的核电荷数比Al的核电荷数大,S的原子半径比Al的原子半径小 |
12.以下说法正确的是( )
| A. | C60与金刚石一样属于原子晶体 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 分子晶体中必含化学键 | |
| D. | 干冰升华时,分子内的共价键未发生断裂 |
9.下列方程式中,属于水解反应且书写正确的是( )
| A. | SO32-+H2O?HSO3-+OH- | B. | CO32-+2H2O?H2CO3+2 OH- | ||
| C. | HS-+H2O?H3O++S2- | D. | Al3++3H2O=Al(OH)3↓+3H+ |
16.下列物质的化学键类型、晶体类型与空间构型均相同的是( )
| A. | NaCl CsCl | B. | CO2 SiO2 | C. | BF3 SO3 | D. | CaF2BeCl2 |
13.一种耐高温、高强度的材料氮化硅,它的化学式可能是( )
| A. | Si3N4 | B. | SiN | C. | Si2N3 | D. | Si4N3 |
4.生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
下列说法中正确的是( )
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
| A. | NF3分子的立体构型是平面三角形 | |
| B. | 过程N(g)+3F(g)→NF3(g)放出能量 | |
| C. | 反应N2(g)+3F2(g)→2NF3(g)的△H>0 | |
| D. | NF3常温下呈气态,是因为N-F键能大,很稳定 |
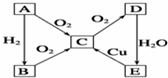 已知,A为空气中含量最多的单质.根据如图转化关系,回答下列问题:
已知,A为空气中含量最多的单质.根据如图转化关系,回答下列问题: