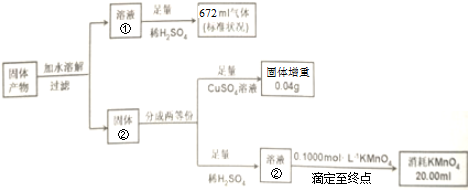
题目内容
16.如表是元素周期表的一部分,针对表中的①~⑦种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)第三周期的元素形成的单原子离子半径最大的是P3-(填化学式).
(3)①和②按质量比3:8形成的化合物A的电子式为
 ,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.(4)用电子式表示元素④与⑦的化合物的形成过程:
 .
.
分析 由元素在周期表中位置,可知①为C、②为O、③为F、④为Na、⑤为Al、⑥为P、⑦为S、⑧为Cl.
(1)HF分子之间存在氢键,沸点高于HCl;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(3)①和②按质量比3:8形成的化合物A中C、O原子数目之比为$\frac{3}{12}$:$\frac{8}{16}$=1:2,故A为CO2;②和⑤形成的阴离子的盐为偏铝酸盐,向偏铝酸盐溶液中通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢盐;
(4)元素④与⑦的化合物为Na2S,由钠离子与硫离子构成.
解答 解:由元素在周期表中位置,可知①为C、②为O、③为F、④为Na、⑤为Al、⑥为P、⑦为S、⑧为Cl.
(1)HF分子之间存在氢键,HCl分子之间为范德华力,氢键比范德华力更强,故HF沸点高于HCl,
故答案为:HF;HF分子之间存在氢键,HCl分子之间为范德华力,氢键比范德华力更强;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故第三周期的元素形成的单原子离子半径最大的是P3-,故答案为:P3-;
(3)①和②按质量比3:8形成的化合物A中C、O原子数目之比为$\frac{3}{12}$:$\frac{8}{16}$=1:2,故A为CO2,电子式为 ,②和⑤形成的阴离子的盐为偏铝酸盐,向偏铝酸盐溶液中通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢盐,反应离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
,②和⑤形成的阴离子的盐为偏铝酸盐,向偏铝酸盐溶液中通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢盐,反应离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为: ;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)元素④与⑦的化合物为Na2S,由钠离子与硫离子构成,应电子式表示形成过程为: ,
,
故答案为: .
.
点评 本题考查元素周期表与元素周期律应用,难度不大,注意掌握用电子式表示化学键或物质的形成.

 阅读快车系列答案
阅读快车系列答案| A. | 1 mol<n≤2 mol | B. | 1 mol<n≤4 mol | C. | 2 mol<n≤4 mol | D. | n>4 mol |
| A. | Na4S2O3 | B. | CaOCl2 | C. | KAl(SO4)2 | D. | Ca(NO3)Cl |
 ,有机物A的健线式结构为
,有机物A的健线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )| A. | 有机物A的一氯取代物只有5种 | |
| B. | 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 | |
| C. | 有机物A的分子式为C8H18 | |
| D. | B的结构可能有3种,其中一种名称为2,2,3-三甲基-2-戊烯 |
| A. | c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-) | |
| B. | c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) | |
| C. | HCO3- 的电离程度大于HCO3-的水解程度 | |
| D. | 存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?H++CO32-,H2O?H++OH-等 |
| A. | 称取10.6gNaCO3,加入100mL容量瓶中,加水溶解,定容 | |
| B. | 称取10.6gNaCO3,加入100mL蒸馏水,搅拌,溶解 | |
| C. | 移液时未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,反复倒转,摇匀 |