题目内容
10.下列有关碱金属元素的叙述正确的是( )| A. | 碱金属元素的阳离子随核电荷数增加,氧化性渐弱而还原性渐强 | |
| B. | 碱金属元素的原子半径越大,越易失电子,其单质还原性越强 | |
| C. | 随核电荷数增多,碱金属单质的熔点一定渐低,密度一定渐大 | |
| D. | 碱金属单质的金属性强,均易与Cl2、O2、N2等发生反应 |
分析 A.碱金属元素金属性越强,其阳离子氧化性越弱;
B.碱金属元素原子半径随着原子序数增大而增大,元素的金属性越强,其单质还原性越强,其原子失电子能力越强;
C.随着核电荷数增大,碱金属单质的熔沸点较低,其密度呈增大趋势;
D.碱金属元素原子最外层只有一个电子,所以碱金属的金属性很强,其单质越易与非金属反应.
解答 解:A.碱金属元素金属性越强,其阳离子氧化性越弱,碱金属阳离子没有还原性,故A错误;
B.碱金属元素原子半径随着原子序数增大而增大,元素的金属性越强,其单质还原性越强,其原子失电子能力越强,所以碱金属元素的原子半径越大,越易失电子,其单质还原性越强,故B正确;
C.随着核电荷数增大,碱金属单质的熔沸点较低,其密度呈增大趋势,但Na密度大于K,故C错误;
D.碱金属单质的原子最外层只有1个电子,反应中容易失去电子,表现强的金属性,所以性质活泼,能够与氯气、氧气、氮气等发生反应,故D正确;
故选BD.
点评 本题考查碱金属元素周期律,为高频考点,明确同一主族原子结构、元素性质递变规律是解本题关键,注意规律中的反常现象,易错选项是C.

练习册系列答案
相关题目
20.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
5.向某密闭容器中加人0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应:aA(g)+bB(g)?cC(g),a、b、c均为正整数,各物质浓度随时间变化如图所示,O~t1min内B的浓度变化没有画出来.下列说法正确的是( )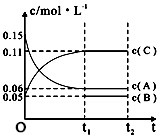

| A. | 若a=3,则b=1,c=2 | |
| B. | t1min时,该反应达到该条件下的反应限度 | |
| C. | 在O~t1min内,用C表示的化学反应速率为0.06mol•L-1 | |
| D. | B的起始浓度等于0.08mol•L-1 |
2. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;
(2)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”或“偏低”或“无影响”);
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL;
(4)根据下列数据:
计算得出待测烧碱溶液的物质的量浓度为0.08000mol•L-1.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;
(2)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”或“偏低”或“无影响”);
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL;
(4)根据下列数据:
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
9.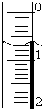 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如右图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=4.5g/100mL
(2)在本实验滴定过程中,下列操作会使实验结果偏大是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测溶液后,再加少水
d.锥形瓶在滴定时剧烈摇动,有少液体溅出.
 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如右图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=4.5g/100mL
(2)在本实验滴定过程中,下列操作会使实验结果偏大是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测溶液后,再加少水
d.锥形瓶在滴定时剧烈摇动,有少液体溅出.
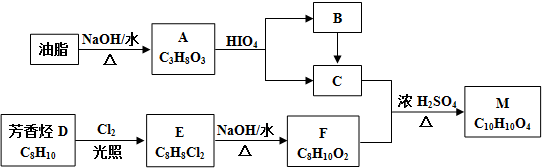
 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$  +
+
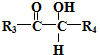 $\stackrel{HIO_{4}}{→}$R3COOH+
$\stackrel{HIO_{4}}{→}$R3COOH+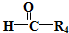
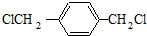 .
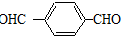
.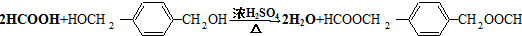 .
.
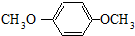

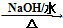 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 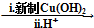 HCOOH
HCOOH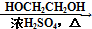 HCOOCH2CH2OOCH.
HCOOCH2CH2OOCH.