题目内容
一包白色粉末由下列盐:Na2CO3、NaHCO3、K2CO3、CuSO4、CaCl2中的两种盐组成①取少量该粉末溶于水,得无色溶液②向该溶液中加入适量稀硫酸后,有无色、无味的气体逸出③若把此气体通过过量的某淡黄色固体粉末,逸出气体使气体木条余烬复燃.
(1)该白色粉末中肯定没有
(2)该白色粉末可能的组成是
(3)确定该白色粉末中是否含有K+的方法是 .
(1)该白色粉末中肯定没有
(2)该白色粉末可能的组成是
(3)确定该白色粉末中是否含有K+的方法是
考点:几组未知物的检验
专题:物质检验鉴别题
分析:①取少量该粉末溶于水,得无色溶液,一定不含有溶于水产生蓝色的硫酸铜;
②向该溶液中加入适量稀硫酸后,有无色、无味的气体逸出,一定含有Na2CO3、NaHCO3、K2CO3的一种或几种,若存在碳酸盐,那么钙盐一定不能存在;
③若把此气体通过过量的某淡黄色固体粉末,逸出气体使气体木条余烬复燃,此气体是氧气,据此解答即可.
②向该溶液中加入适量稀硫酸后,有无色、无味的气体逸出,一定含有Na2CO3、NaHCO3、K2CO3的一种或几种,若存在碳酸盐,那么钙盐一定不能存在;
③若把此气体通过过量的某淡黄色固体粉末,逸出气体使气体木条余烬复燃,此气体是氧气,据此解答即可.
解答:
解:(1)依据①知所得溶液为无色,故一定不含有硫酸铜,因为硫酸铜溶于水显蓝色,故答案为:CuSO4;
(2)依据②得出可能组成为:Na2CO3、NaHCO3,Na2CO3、K2CO3,NaHCO3、K2CO3或NaHCO3、CaCl2,
故答案为:Na2CO3、NaHCO3,Na2CO3、K2CO3,NaHCO3、K2CO3或NaHCO3、CaCl2;
(3)要验证钾离子的存在,需要做焰色反应实验,若透过蓝色钴玻璃,发现有紫色火焰产生,那么一定含有钾离子,否则没有,故答案为:做焰色反应实验,若透过蓝色钴玻璃,发现有紫色火焰产生,那么一定含有钾离子,否则没有.
(2)依据②得出可能组成为:Na2CO3、NaHCO3,Na2CO3、K2CO3,NaHCO3、K2CO3或NaHCO3、CaCl2,
故答案为:Na2CO3、NaHCO3,Na2CO3、K2CO3,NaHCO3、K2CO3或NaHCO3、CaCl2;
(3)要验证钾离子的存在,需要做焰色反应实验,若透过蓝色钴玻璃,发现有紫色火焰产生,那么一定含有钾离子,否则没有,故答案为:做焰色反应实验,若透过蓝色钴玻璃,发现有紫色火焰产生,那么一定含有钾离子,否则没有.
点评:本题主要考查的是无机物的推断,熟练掌握各种物质的性质以及它们之间的反应是解决本题的关键.

练习册系列答案
相关题目
碳化硅又称金刚砂,他的分解温度很高,硬度极大,溶解性与化学活泼性都很差推断下列物质中与它的结构类似的是( )
| A、金刚石 | B、氯化钠 | C、石墨 | D、水 |
为了检验某卤代烃(R-X)中的X元素,在下列实验操作中:①加热②加入硝酸银溶液③取少量卤代烃④加入稀硝酸溶液酸化⑤加入氢氧化钠溶液⑥冷却,所选择的正确的操作顺序是( )
| A、③⑤④② |
| B、③⑤①④② |
| C、③⑤①⑥② |
| D、③⑤①⑥④② |
可以用分液漏斗分离的一组混合物是( )
| A、苯和水 | B、酒精和碘 |
| C、醋酸和水 | D、碘和四氯化碳 |
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)
已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是( )
已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是( )

| A、其热化学方程式为:Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)△H>0 |
| B、温度为T1、T2时,化学反应速率分别为v1、v2,则v2<v1 |
| C、反应处于状态D时,一定有v正>v逆 |
| D、A点与B点相比,A点的c(Fe3+)大 |
X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池,X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应.据此判断金属的活动性顺序是( )
| A、Y>W>Z>X |
| B、X>Z>W>Y |
| C、Z>X>Y>W |
| D、X>Y>Z>W |
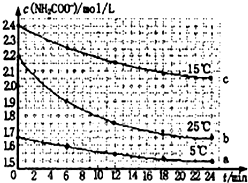 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.