题目内容
 为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如右图所示.请依图回答下列问题:
为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如右图所示.请依图回答下列问题:(1)反应速率最快的时间段是
A.0~2min B.2~4min C.4~6min
(2)参加反应的CaCO3的质量为
(3)用溶液中H+离子浓度的减小来表示该反应在反应开始到2min内的平均反应速度为
(4)在0~2min反应速率逐渐增大的原因可能是
(5)欲加快CO2的生成速率,但不改变产生气体的总量,可采取的措施是
A.改用1000mL2.0mol/L 的稀盐酸
B.改用250mL 4.0mol/L 的稀盐酸
C.用500mL 2.0mol/L 稀硫酸代替稀盐酸
D.将CaCO3颗粒改为粉末.
考点:探究温度、压强对化学反应速率的影响
专题:
分析:(1)v=
来求解;同一容器中单位时间同一物质的物质的量变化越大反应速率越快,据图分析,反应速率逐渐加快,说明反应放热;
(2)据生成二氧化碳物质的量,计算参加反应的CaCO3的质量;
(3)据生成二氧化碳物质的量,计算反应的盐酸的物质的量,求算v(H+);
(4)从反应的热效应分析解答;
(5)可以增加氢离子的浓度,但物质的量不变;也可以增加接触面积.
| △c |
| △t |
(2)据生成二氧化碳物质的量,计算参加反应的CaCO3的质量;
(3)据生成二氧化碳物质的量,计算反应的盐酸的物质的量,求算v(H+);
(4)从反应的热效应分析解答;
(5)可以增加氢离子的浓度,但物质的量不变;也可以增加接触面积.
解答:
解:(1)0-2min,生成二氧化碳0.1mol,2-4min,生成二氧化碳0.2mol,4-6min,生成二氧化碳0.1mol,相同时间内,2-4min产生气体最多,故选B;
(2)据生成二氧化碳物质的量,n(CaCO3)=n(CO2)=0.35mol,所以m(CaCO3)=0.35mol×100g/mol=35g,故答案为:35;
(3)在0~2min内生成二氧化碳0.1mol,则参加反应的HCl物质的量为0.2mol,v(H+)=
=
=0.2mol/(L?min),故答案为:0.2mol/(L?min);
(4)在0~2min反应速率逐渐增大的原因可能是,随反应进行,反应速率加快,说明反应放热反应,温度升高反应速率加快,故答案为:反应为放热反应;
(5)可以增加氢离子的浓度,但物质的量不变;也可以增加接触面积,
A.改用1000mL2.0mol/L 的稀盐酸,速率不变,但以改变物质的量,故错误;
B.改用250mL 4.0mol/L 的稀盐酸,浓度变大速率加快,但氢离子的物质的量不变,故正确;
C.用500mL 2.0mol/L 稀硫酸代替稀盐酸,生成微溶的硫酸钙,反应速率减慢,故错误;
D.将CaCO3颗粒改为粉末,加快反应速率,但氢离子的物质的量不变,故正确;
故选BD.
(2)据生成二氧化碳物质的量,n(CaCO3)=n(CO2)=0.35mol,所以m(CaCO3)=0.35mol×100g/mol=35g,故答案为:35;
(3)在0~2min内生成二氧化碳0.1mol,则参加反应的HCl物质的量为0.2mol,v(H+)=
| △c |
| △t |
| ||
| 2min |
(4)在0~2min反应速率逐渐增大的原因可能是,随反应进行,反应速率加快,说明反应放热反应,温度升高反应速率加快,故答案为:反应为放热反应;
(5)可以增加氢离子的浓度,但物质的量不变;也可以增加接触面积,
A.改用1000mL2.0mol/L 的稀盐酸,速率不变,但以改变物质的量,故错误;
B.改用250mL 4.0mol/L 的稀盐酸,浓度变大速率加快,但氢离子的物质的量不变,故正确;
C.用500mL 2.0mol/L 稀硫酸代替稀盐酸,生成微溶的硫酸钙,反应速率减慢,故错误;
D.将CaCO3颗粒改为粉末,加快反应速率,但氢离子的物质的量不变,故正确;
故选BD.
点评:本题考查化学反应速率的计算,以及影响化学反应速率的因素,比较简单.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列分子中,各原子均处于同一平面上的是( )
| A、NH3 |
| B、CCl4 |
| C、H2O |
| D、CH4 |
下列物质中既有极性键又有非极性键的非极性分子是( )
| A、CS2 |
| B、CH4 |
| C、CH3Cl |
| D、CH≡CH |
下列离子方程式正确的是( )
| A、钾跟水反应:K+2H2O=K++2OH-+H2↑ |
| B、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| C、硫酸氢钠溶液与NaOH溶液混合:HSO4-+OH-=H2O+SO42- |
| D、氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A、NH4HCO3和盐酸的反应是放热反应 |
| B、该反应中,热能转化为产物内部的能量 |
| C、反应物的总能量高于生成物的总能量 |
| D、反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O H>0 |
下列各项表述与示意图一致,且文字图示均正确的是( )
A、 表示第三周期元素原子半径的变化规律 表示第三周期元素原子半径的变化规律 |
B、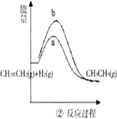 a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0在使用和未使用催化剂时,反应过程中的能量变化 |
C、 实验用于测定稀盐酸的浓度 |
D、 实验可用于验证HCl在水中的溶解性 |
2007年1月8日,国防科工委举行新闻发布会,明确承认“中国具备制造航空母舰的能力”.初步计划,预计国产大功率镍氢动力电池将在制造航空母舰中发挥作用.常见镍氢电池的某极是储氢合金LaNi6H6(LaNi6H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+6NiO(OH)
LaNi6+6Ni(OH)2下列说法不正确的是( )
| 放电 |
| 充电 |
| A、放电时储氢合金作负极 |
| B、充电时储氢合金作阴极 |
| C、1molLaNi5H6参加放电,能提供12mol电子 |
| D、充电是将电能转化为化学能的过程 |


