题目内容
20. (Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算:
(Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算:(1)该氯化氢气体的质量为1.825g
(2)该氯化氢气体中含有的电子数目为0.9NA(用NA表示)
(3)该溶液的物质的量浓度为0.5mol/L.
(Ⅱ)下列对象中所含分子数由少到多的顺序是③②①④(填序号2分):
①通常情况下,16克氧气和14克氮气的混合气体;②标准状况下,22.4L氦气和5.6L二氧化碳的混合气体;③含电子总数为1.204×1024的氨气;④1L 0.5mol/L的蔗糖溶液中的蔗糖分子
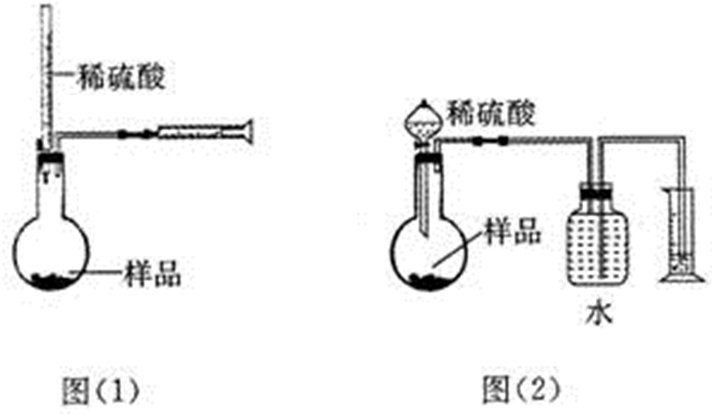
(Ⅲ)如图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度是18.4mol•L-1.
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL 4.6mol•L-1的稀硫酸,则需要取62.5mL的该硫酸.
(3)用上述硫酸配制240mL 4.6mol•L-1的稀硫酸,若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.定容前容量瓶底部有水珠无影响;
B.最终定容时俯视观察液面偏高.
分析 (Ⅰ)(1)根据n=$\frac{V}{{V}_{m}}$计算出氯化氢的物质的量,再根据m=nM计算出氯化氢的质量;
(2)氯化氢分子中含有18个电子,0.05mol氯化氢分子中含有0.5mol电子;
(3)根据c=$\frac{n}{V}$计算出所得溶液的物质的量浓度;
(Ⅱ)根据N=nNA可知,物质的量越大,含有的分子数越多,分别计算出各选项中气体的物质的量即可判断含有的分子数多少;
(Ⅲ)(1)根据c=$\frac{1000ρω}{M}$计算出该浓硫酸的物质的量浓度;
(2)需要240mL 4.6mol•L-1的稀硫酸,需要配制250mL 4.6mol/L的稀硫酸,根据配制过程中溶质的物质的量不变计算出需要浓硫酸的体积;
(3)A.容量瓶中的水珠不影响最终溶液体积;
B.定容时俯视观察液面,会导致加入的蒸馏水体积偏小,配制的溶液浓度偏高.
解答 解:(Ⅰ)(1)标准状况下1.12LHCl的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,含有氯化氢的质量为:36.5g/mol×0.05mol=1.825g,
故答案为:1.825g;
(2)0.05molHCl中含有电子的物质的量为:18×0.05mol=0.9mol,则含有电子的数目为0.9NA,
故答案为:0.9NA;
(3)该溶液的物质的量浓度为:c=$\frac{0.05mol}{0.1L}$=0.5mol/L,
故答案为:0.5 mol/L;
(Ⅱ)根据N=nNA可知,物质的量越大,含有的分子数越多,
①通常情况下,16克氧气和14克氮气的混合气体中含有气体的总物质的量为:$\frac{16g}{32g/mol}$+$\frac{14g}{28g/mol}$=1mol;
②标准状况下,22.4L氦气和5.6L二氧化碳的混合气体的总物质的量为:$\frac{22.4L+5.6L}{22.4L/mol}$=1.25mol;
③氨气分子中含有10个电子,则含电子总数为1.204×1024的氨气的物质的量为:$\frac{1.204×1{0}^{24}}{10×6.02×1{0}^{23}}$mol=0.2mol;
④1L 0.5mol/L的蔗糖溶液中含有蔗糖分子的物质的量为:0.5mol/L×1L=0.5mol,
所以含有分子数由小到大的顺序为:③②①④,
故答案为:③②①④;
(Ⅲ)(1)该浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故答案为:18.4;
(2)配制240mL 4.6mol•L-1的稀硫酸,实验室中没有240mL的容量瓶,需要配制250mL的稀硫酸,配制过程中硫酸的物质的量不变,则需要18.4mol/L的浓硫酸的体积为:$\frac{4.6mol/L×0.25L}{18.4mol/L}$=0.0625L=62.5mL,
故答案为:62.5;
(3)A.定容前容量瓶底部有水珠,对最终配制的溶液体积无影响,所以不影响配制结果,
故答案为:无影响;
B.最终定容时俯视观察液面,导致加入的蒸馏水低于容量瓶的刻度线,则配制的溶液体积偏小,溶液的浓度偏高,
故答案为:偏高.
点评 本题考查了物质的量的计算、物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量等之间的关系为解答关键,注意掌握配制一定物质的量浓度的溶液中的误差分析的方法,试题知识点较多、计算量较大,充分考查了学生的分析能力及化学计算能力.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 用标准的盐酸溶液润洗酸式滴定管2-3次 | |
| B. | 用待测碱液润洗碱式滴定管2-3次 | |
| C. | 用待测碱液润洗锥形瓶2-3次 | |
| D. | 用蒸馏水润洗锥形瓶2-3次 |
| A. | 含4NA个离子的固体Na2 02溶于水配成1L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-l | |
| B. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+02+2H20=2S+40H- | |
| C. | 过量的澄清石灰水分别与Na2C03溶液和NaHCO3溶液反应,现象不同 | |
| D. | 滴加KSCN显红色的溶液中大量存在:NH4+、K+、Cl-、I- |
| A. | 增大压强 | B. | 充入更多N2 | C. | 使用高效催化剂 | D. | 降低温度 |
| A. | ①②③ | B. | ③④ | C. | ②⑤⑥ | D. | ①②③④⑤⑥ |
| A. | 这“某物质”具有还原性 | |
| B. | CuH与盐酸反应,可能产生H2 | |
| C. | CuH与足量的稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O | |
| D. | CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |