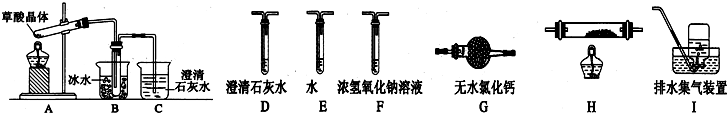
题目内容
13.已知:乙醛在一定条件下可被氧气氧化为乙酸.A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.如图是有机物之间的转化关系: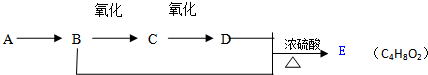
(1)B的结构简式为CH3CH2OH,D的官能团为羧基.
(2)B→C的反应条件为Cu/Ag,加热,B+D→E的反应类型为酯化反应.
(3)写出B+D→E的化学反应方程式:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
分析 A是石油裂解主要产物之一,其产量可以用来衡量一个国家的石油化工水平,A为C2H4,B能发生连续氧化性生成D,则B为醇、C为醛、D为羧酸、E为酯.故乙烯与水发生加成反应生成B,B为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应CH3CHO,C为CH3CHO,CH3CHO可进一步氧化物CH3COOH,D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成乙酸乙酯,故E为CH3COOCH2CH3,据此解答.
解答 解:A是石油裂解主要产物之一,其产量可以用来衡量一个国家的石油化工水平,A为C2H4,B能发生连续氧化性生成D,则B为醇、C为醛、D为羧酸、E为酯.故乙烯与水发生加成反应生成B,B为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应CH3CHO,C为CH3CHO,CH3CHO可进一步氧化物CH3COOH,D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成乙酸乙酯,故E为CH3COOCH2CH3,
(1)由上述分析可知,B为CH3CH2OH,D为CH3COOH,D中的官能团为羧基,
故答案为:CH3CH2OH;羧基;
(2)B→C为醇的催化氧化,所以的反应条件为Cu/Ag,加热,反应B+D→E是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,属于酯化反应,
故答案为:Cu/Ag,加热;酯化反应;
(3)B+D→E反应方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH3+H2O;
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH3+H2O.
点评 本题考查有机物推断,涉及烯烃、醇、醛、羧酸、酯之间的转化,明确有机物中的官能团及其性质是解本题关键,熟练掌握有机物性质、有机反应类型等知识点,题目难度不大.

| A. | v正(CO)=v逆(H2O) | |
| B. | 2 mol H-O键断裂的同时有1 mol H-H键形成 | |
| C. | 生成n mol CO的同时生成n mol H2O(g) | |
| D. | 体系的压强不再发生变化 |
| A. | N2(g)+3H2(g)?2NH3(g)△H<0其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大 | |
| B. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| C. | 合成氨反应是放热反应,所以工业合成氨时温度越低越好 | |
| D. | 恒温、恒容的条件下对于N2(g)+3H2(g)?2NH3(g)△H<0的反应,混合气体的平均相对分子质量不变可以作为其达到化学平衡状态的标志 |
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 1mol氯气跟足量的NaOH溶液完全反应,转移的电子数为2NA | |
| C. | 1mol Na2O含离子数为3NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |
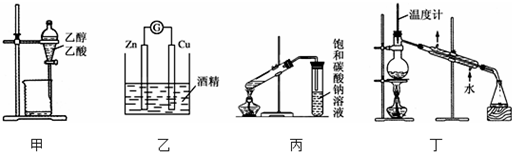
| A. | 甲装置可用来分离乙醇和乙酸 | |
| B. | 乙装置可以构成原电池 | |
| C. | 在制备乙酸乙酯的实验中,丙装置中的饱和碳酸钠可以用氢氧化钠溶液代替 | |
| D. | 丁装置可以用来分离乙醇和丁醇和混合物 |