题目内容
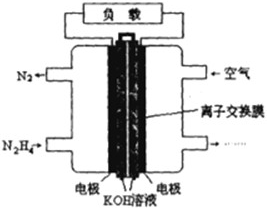 肼(N2H4)是火箭发射常用的燃料.
肼(N2H4)是火箭发射常用的燃料.(1)最新实验研究用肼还原新制Cu(0H)2可制备纳米级Cu2O,同时放出N2.请写出该制法的化学反应方程式
(2)一种以肼(N2H4)为燃料的电池装置如图所示.该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质.
①负极上发生的电极反应为
②电池工作时产生的电流从
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)肼还原新制Cu(0H)2可制备纳米级Cu2O,同时放出N2,结合质量守恒书写方程式,结合元素化合价的变化计算;
(2)该燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电流的方向分析解答.
(2)该燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电流的方向分析解答.
解答:
解:(1)肼还原新制Cu(0H)2可制备纳米级Cu2O,同时放出N2,则反应的方程式为N2H4+4Cu(OH)2═2Cu2O+N2+6H2O,
反应中Cu元素化合价由+2价降低到+1价,则当反应中转移0.2mol电子时,可生成0.1molCu2O,质量为0.1mol×144g/mol=14.4g,
故答案为:N2H4+4Cu(OH)2═2Cu2O+N2+6H2O;14.4g;
(2)①通入燃料的电极为负极,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+4OH--4e-=N2+4H2O,
故答案为:N2H4+4OH--4e-═N2+4H2O;
②原电池工作时,电流由正极经导线流向负极,则由右侧流向左侧,故答案为:右侧;左侧.
反应中Cu元素化合价由+2价降低到+1价,则当反应中转移0.2mol电子时,可生成0.1molCu2O,质量为0.1mol×144g/mol=14.4g,
故答案为:N2H4+4Cu(OH)2═2Cu2O+N2+6H2O;14.4g;
(2)①通入燃料的电极为负极,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+4OH--4e-=N2+4H2O,
故答案为:N2H4+4OH--4e-═N2+4H2O;
②原电池工作时,电流由正极经导线流向负极,则由右侧流向左侧,故答案为:右侧;左侧.
点评:本题考查了燃料电池,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液的酸碱性书写,注意电流的方向和电子的流向相反,难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
关于下列各实验装置的叙述中,不正确的是( )
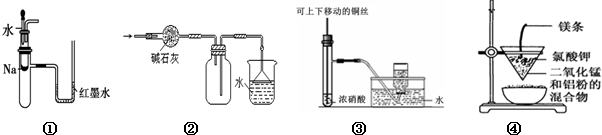

| A、装置①可用于验证Na与H2O反应是否放热 |
| B、装置②可用于干燥、收集NH3,并吸收多余的NH3 |
| C、装置③可用于制备并收集少量NO2 |
| D、装置④可制得金属锰 |
韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”.则关于“暖冰”的判断正确的是( )
| A、“暖冰”中存在离子键 |
| B、“暖冰”中水分子的O-H键是非极性键 |
| C、“暖冰”的密度大,有导电性和导热性 |
| D、水凝固形成20℃时的“暖冰”所发生的变化是物理变化 |
 将一定质量的Mg,Al合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得如图关系.
将一定质量的Mg,Al合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得如图关系.
 酸碱中和滴定在生产实际中有着广泛的应用.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应.请回答下列问题:
酸碱中和滴定在生产实际中有着广泛的应用.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应.请回答下列问题: