题目内容
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态.
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图1,其总反应式为H2+2NiOOH
2Ni(OH)2.根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”),该电极的电极反应 .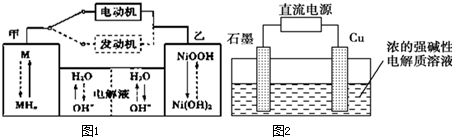
(2)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应式为2Cu+H2O
Cu2O+H2↑,阴极的电极反应式是 .用镍氢电池作为电源进行电解,当电池中有1mol H2被消耗时,Cu2O的理论产量为 g.
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图1,其总反应式为H2+2NiOOH
| 放电 |
| 充电 |

(2)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应式为2Cu+H2O
| ||
考点:化学电源新型电池,原电池和电解池的工作原理
专题:电化学专题
分析:(1)混合动力车上坡或加速时,是原电池中,负极发生失电子发生氧化反应,氢气失电子产生氢离子,溶液的pH变化减小;
(2)在电解池中,阴极是阳离子发生得电子得还原反应,根据电子守恒来计算氢气消耗量和Cu2O的理论产量之间的关系.
(2)在电解池中,阴极是阳离子发生得电子得还原反应,根据电子守恒来计算氢气消耗量和Cu2O的理论产量之间的关系.
解答:
解:(1)混合动力车上坡或加速时,是原电池中,负极失电子发生氧化反应,氢气失电子产生氢离子,溶液的pH变化减小,故答案为:减小;H2-2e-+2OH-=2H2O;
(2)在电解池中,阴极是阳离子氢离子发生得电子得还原反应,即2H++2e-=H2↑,根据电子守恒,当蓄电池中有1mol H2被消耗时,转移电子是2mol,当转移2mol电子时,根据电解反应:2Cu+H2O
Cu2O+H2,Cu2O的生成量为1mol,质量为144g,故答案为:2H++2e-=H2↑;144.
(2)在电解池中,阴极是阳离子氢离子发生得电子得还原反应,即2H++2e-=H2↑,根据电子守恒,当蓄电池中有1mol H2被消耗时,转移电子是2mol,当转移2mol电子时,根据电解反应:2Cu+H2O
| ||
点评:本题考查学生有关电化学和热化学的知识,综合性较强,难度较大.

练习册系列答案
相关题目
下列关于阿伏伽德罗常数的叙述,错误的是( )
| A、1L 1mol/L的次氯酸钠溶液中含有次氯酸根离子的数目为NA |
| B、1mol氯气和足量NaOH溶液反应转移的电子书为2NA |
| C、10L 0.1mol/L的碳酸钠溶液中,钠离子、碳酸根离子的总数为3NA |
| D、在含4mol Si-O键的二氧化硅晶体中,氧原子的数目为4NA |
能正确表示下列反应的离子方程式是( )
| A、铝与氢氧化钠溶液反应:2Al+2OH-=2AlO2-+3H2O |
| B、将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| C、向氢氧化钠溶液中通入少量CO2:OH-+CO2=HCO3- |
| D、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O |
下列说法正确的是( )
| A、凡分子组成符合Cn(H2O)m的化合物属糖类 |
| B、有甜味的物质一定属于糖类 |
| C、糖类可看做是碳的水化物 |
| D、糖类物质在空气中燃烧都生成CO2和H2O |
下列各组溶液中,离子一定能大量共存的是( )
| A、强碱溶液中:Na+、Mg2+、SO42-、AlO2- |
| B、某无色溶液中:NH4+、Fe3+、MnO4-、NO3- |
| C、含有0.1mol/L Fe3+溶液中:K+、Mg2+、Cl-、SCN- |
| D、与铝反应生成H2的溶液中:Na+、K+、Cl-、SO42- |

 肼(N2H4)是火箭发射常用的燃料.
肼(N2H4)是火箭发射常用的燃料.