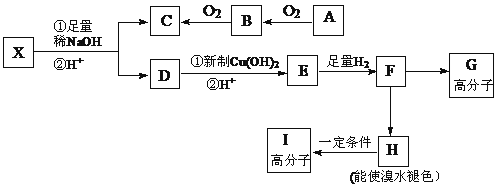
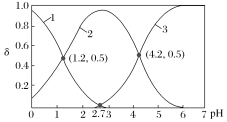
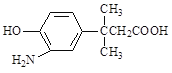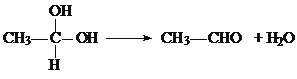题目内容
【题目】过氧化钙晶体CaO2·8H2O不溶于水,遇水缓慢地分解,放出氧气,是一种用途广泛的优良供氧剂,某学习小组欲利用工业废渣CaCl2(含生石灰和熟石灰)制取CaO2·8H2O,发现用Ca(OH)2和H2O2直接反应,生成杂质较多,按下列方法制取过氧化钙晶体,请回答:
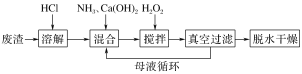
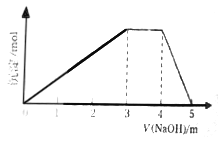
下列说法不正确的是( )
A.Ca(OH)2的主要作用是调节溶液酸碱性和循环母液反应产生氨气
B.为了加快反应,搅拌时应该在较低温度下进行
C.真空过滤的目的是加快过滤,减少和水反应
D.搅拌步骤中加入了双氧水,发生了氧化还原反应
【答案】D
【解析】
A. H2O2与CaCl2、NH3反应,生成CaO2和NH4Cl,Ca(OH)2调节溶液的酸碱性,并和循环母液中的NH4Cl反应生成氨气,A正确;
B.为了加快反应,应不断搅拌,为防温度较高时H2O2分解,应该在较低温度下进行,B正确;
C. 过氧化钙遇水缓慢地分解,所以产生过氧化钙后,应尽快脱离水环境,C正确;
D. 搅拌步骤中的反应是CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O+2NH4Cl,没有发生氧化还原反应,D错误;
故选D。

练习册系列答案
相关题目
【题目】右图为浓硫酸与铜片反应的装置。

请回答:
(1)浓硫酸与铜片反应的化学方程式为 。
(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法中,不正确的是 。
A.该反应中浓硫酸只体现酸性 |
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染 |
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色 |
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况) |