题目内容
12.在一定条件下,将N2和H2按体积比1:3混合充入某密闭容器,发生反应:N2+3H2?2NH3.当反应达到平衡时,测得NH3的体积分数为40%,则N2在平衡混合气体中的体积分数为( )| A. | 40% | B. | 20% | C. | 15% | D. | 60% |
分析 N2和H2按体积比1:3混合充入某密闭容器中,设氮气转化率为x,
N2+3H2=2NH3
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
根据平衡混合气中NH3的体积分数为40%,有$\frac{2x}{4-2x}$=40%,由此计算得x,进而确定N2在平衡混合体系中的体积分数.
解答 解:N2和H2按体积比1:3混合充入某密闭容器中,设氮气转化率为x,
N2+3H2=2NH3
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
根据平衡混合气中NH3的体积分数为40%,有$\frac{2x}{4-2x}$=40%,
得到x=$\frac{4}{7}$,所以N2在平衡混合体系中的体积分数为$\frac{1-\frac{4}{7}}{4-2×\frac{4}{7}}$×100%=15%,
故选C.
点评 本题考查了化学平衡的三段式计算应用,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,答题时注意体积分数的计算公式的应用.

练习册系列答案
相关题目
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L | |
| B. | 30 g乙烷中含共用电子对总数为8NA | |
| C. | 常温常压下,11.2 L氮气所含的原子数目为NA | |
| D. | 常温下,0.05 mol CO2和SO2混合气体中所含氧原子数为0.1NA |
17.有机物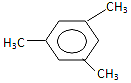 用系统命名法命名的名称为( )
用系统命名法命名的名称为( )
 用系统命名法命名的名称为( )
用系统命名法命名的名称为( )| A. | 间三甲苯 | B. | 1,3,5-三甲苯 | C. | 三甲苯 | D. | 1-3-5,三甲苯 |
14.将amolH2、Cl2混合气体(体积比为1:2)经光照充分反应后,所得气体恰好使溶液中bmolNaOH完全转变为盐,则a、b的关系为( )
| A. | a=b | B. | 2a=b | C. | 4a=3b | D. | 2a=3b |
7.已知: ,且烷烃满足下列条件:
,且烷烃满足下列条件:
①主链含5个碳原子 ②两个支链:一个甲基、一个乙基,n、m的最大值分别为( )
 ,且烷烃满足下列条件:
,且烷烃满足下列条件:①主链含5个碳原子 ②两个支链:一个甲基、一个乙基,n、m的最大值分别为( )
| A. | 2、2 | B. | 2、4 | C. | 4、2 | D. | 4、5 |
4.对于苯乙烯(  )有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面.其中正确的是( )
)有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面.其中正确的是( )
 )有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面.其中正确的是( )
)有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面.其中正确的是( )| A. | ①②④⑤⑥ | B. | ①②③④⑤ | C. | ①②⑤⑥ | D. | 全部正确 |
1.根据对角线规则,下列物质的性质具有相似性的是( )
| A. | 硼和砷 | B. | 铝和铁 | C. | 铍和铝 | D. | 铜和金 |
 ,
,
 、
、 .
. 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将直流电源接通后,向(乙)中滴入酚酞荣特,在F极附近呈红色.
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将直流电源接通后,向(乙)中滴入酚酞荣特,在F极附近呈红色.