题目内容
6. 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.根据以上信息回答下列问题:
(1)写出B原子核外电子排布式:1s22s22p63s1.
(2)A的氢化物由固体变为气态所需克服的微粒间的作用力有氢键、范德华力.
(3)B的氧化物的熔点比D的氧化物的熔点低(填“高”或“低”);理由是Na2O是离子晶体,SiO2是原子晶体.
(4)E的最高价氧化物分子的空间构型是平面正三角形,是非极性(填“极性”或“非极性”)分子.
(5)E、F形成的某种化合物有如图所示的晶体结构:该化合物化学式为ZnS;E原子配位数为4.
分析 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,A原子2p轨道有3个未成对电子,外围电子排布为2s22p3,故A为N元素;C元素是地壳中含量最高的金属元素,则C为Al;E原子核外的M层中只有两对成对电子,外围电子排布为3s22p3,故E为S元素;化合物B2E的晶体为离子晶体,B为+1价,原子序数大于氧、小于Al,故B为Na;D属于第三周期元素,且D单质的晶体熔点在同周期形成的单质中是最高的,则D为Si;F为过渡元素,F2+核外各电子层电子均已充满,原子核外电子数为2+8+18+2=30,故F为Zn,据此解答.
解答 解:周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,A原子2p轨道有3个未成对电子,外围电子排布为2s22p3,故A为N元素;C元素是地壳中含量最高的金属元素,则C为Al;E原子核外的M层中只有两对成对电子,外围电子排布为3s22p3,故E为S元素;化合物B2E的晶体为离子晶体,B为+1价,原子序数大于氧、小于Al,故B为Na;D属于第三周期元素,且D单质的晶体熔点在同周期形成的单质中是最高的,则D为Si;F为过渡元素,F2+核外各电子层电子均已充满,原子核外电子数为2+8+18+2=30,故F为Zn.
(1)B为Na元素,原子核外电子排布式:1s22s22p63s1,故答案为:1s22s22p63s1;
(2)A的氢化物为NH3,固体分子之间存在氢键、范德华力,由固体变为气态所需克服的微粒间的作用力有:氢键、范德华力,故答案为:氢键、范德华力;
(3)Na2O是离子晶体,SiO2是原子晶体,故熔点:Na2O<SiO2,
故答案为:低;Na2O是离子晶体,SiO2是原子晶体;
(4)E的最高价氧化物为SO3,分子中S原子孤电子对数为$\frac{6-2×3}{2}$=0,价层电子对数为3+0=3,为平面正三角形结构,为对称结构,分子中正负电荷重心重合,为非极性分子,
故答案为:平面正三角形;非极性;
(5)分子中Zn原子数目为4、S原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为ZnS,F原子配位数为4,为1:1型化合物,故E原子配位数为4,
故答案为:ZnS;4.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、氢键、熔点高低比较、空间构型、分子极性、晶胞结构与计算等,注意对基础知识的理解掌握.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | 有尘埃的空气 | B. | 食盐水 | C. | 稀豆浆 | D. | 水 |
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | N、P、F原子半径依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
| A. | 常温常压下,1molCH4分子中含有8NA个电子 | |
| B. | 常温常压下,11.2LO3中含有0.5NA个O3分子 | |
| C. | 0.1mol/LNa2SO4溶液中含Na+的数目为0.2NA | |
| D. | Na2O2与水反应产生1molO2时,转移2NA个电子 |
| A. | 焦糖烯能使溴水褪色 | |
| B. | “半成品碳”是碳元素的一种新单质 | |
| C. | 蔗糖溶液与新制的氢氧化铜悬浊液混合加热有砖红色沉淀生成 | |
| D. | 焦糖烯是一种新型的烯经 |
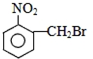
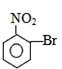
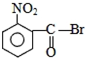
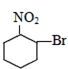
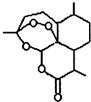 合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.
合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.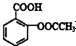 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为: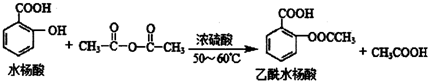
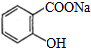 .
.