题目内容
3.已知500mL 0.2mol/L的硫酸与含11.2g氢氧化钾的稀溶液反应,放出热量11.46kJ,表示该反应中和热的化学方程式为:$\frac{1}{2}$H2SO4(aq)+KOH(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.分析 n(H2SO4)=0.5L×0.2mol/L=0.1mol,n(KOH)=$\frac{11.2g}{56g/mol}$=0.2mol,则生成0.2molH2O(l)放出热量11.46kJ,生成1molH2O(l)放出热量为$\frac{11.46kJ}{0.2}$=57.3kJ,以此来解答.
解答 解:n(H2SO4)=0.5L×0.2mol/L=0.1mol,n(KOH)=$\frac{11.2g}{56g/mol}$=0.2mol,则生成0.2molH2O(l)放出热量11.46kJ,生成1molH2O(l)放出热量为$\frac{11.46kJ}{0.2}$=57.3kJ,则表示该反应中和热的化学方程式为为$\frac{1}{2}$H2SO4(aq)+KOH(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1,
故答案为:$\frac{1}{2}$H2SO4(aq)+KOH(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.
点评 本题考查热化学方程式的书写,为高频考点,把握反应中能量变化、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意中和热的判断,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
20.在四片玻璃片上分别滴有下列溶液,当氨气靠近各玻璃片时,有白烟产生的是( )
| A. | 浓硫酸 | B. | 浓磷酸 | ||
| C. | 浓硝酸 | D. | 浓的氢氧化钠溶液 |
17.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速度加大的是( )
| A. | 加热 | B. | 不能稀硫酸而用浓硫酸 | ||
| C. | 往溶液中加入少量CuSO4固体 | D. | 不能铁片而用铁粉 |
4.下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
| A. | Na和O2 | B. | NaOH和SO2 | C. | NaHCO3和NaOH | D. | Na2CO3和HCl |
15.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 2 mol•L-1NaCl溶液中含有Na+个数为2NA | |
| B. | 标准态况下,22.4 LH2O含有水分子数为NA | |
| C. | 71g氯气与足量铁粉充分反应,转移的电子数为3NA | |
| D. | 标准状况下,16gO2和O3的混合气体中原子的物质的量为1mol |
12.溶质分子(或离子)和水分子结合后成水合分子(水合离子)的过程是( )
| A. | 物理过程,吸收热量 | B. | 化学过程,吸收热量 | ||
| C. | 物理过程,放出热量 | D. | 化学过程,放出热量 |
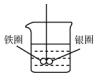 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平痕.小心地从烧杯中央滴入CuSO4溶液.
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平痕.小心地从烧杯中央滴入CuSO4溶液. 已知A石油裂解的主要产物,相对分子质量为28.B为气体,在标准状况下的密度为1.96g/L.D与F互为同分异构体,F是环状化合物.G的结构简式为:
已知A石油裂解的主要产物,相对分子质量为28.B为气体,在标准状况下的密度为1.96g/L.D与F互为同分异构体,F是环状化合物.G的结构简式为: ,在一定条件下,它们有如图转化关系.
,在一定条件下,它们有如图转化关系.