题目内容
15.下列叙述中正确的是( )| A. | 氧化还原反应中,一种元素被氧化,一定是另一种元素被还原 | |
| B. | 某元素由化合态变成游离态,此元素可能被氧化,也可能被还原 | |
| C. | 金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
分析 A.可能只有一种元素化合价变化;
B.可能得到电子或失去电子转化为单质;
C.非金属可能作还原剂;
D.金属还原性与失去电子的多少无关.
解答 解:A.可能只有一种元素化合价变化,如氯气与水的反应中,只有Cl元素被氧化也被还原,故A错误;
B.可能得到电子或失去电子转化为单质,如二氧化硫与硫化氢反应生成S和水,S元素被氧化,也被还原,故B正确;
C.非金属可能作还原剂,如C与水反应中C为还原剂,金属在反应中只能失去电子作还原剂,故C错误;
D.金属还原性与失去电子的多少无关,与失去电子的难易有关,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.

练习册系列答案
相关题目
6.已知某饱和溶液中①溶质的质量 ②溶剂的质量 ③溶液的体积 ④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度,
从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
| A. | ④⑤⑥ | B. | ①②③④ | C. | ①②④⑥ | D. | ②③④ |
3.下列离子检验的推理正确的是( )
| A. | 向某溶液中加盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中有CO32- | |
| B. | 向某溶液中加石蕊试液,溶液变蓝,则原溶液中溶质是碱 | |
| C. | 向某溶液中加氢氧化钠溶液,生成蓝色沉淀,则原溶液中有Cu2+ | |
| D. | 向某溶液中加氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,则原溶液中有SO42- |
10.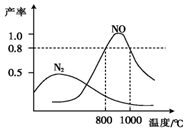 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
4NH3(g)+3O2(g)$\stackrel{催化剂}{?}$2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g)$\stackrel{催化剂}{?}$4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:4NH3(g)+3O2(g)$\stackrel{催化剂}{?}$2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g)$\stackrel{催化剂}{?}$4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
| A. | v(N2)=v(NO) | |
| B. | 反应①的焓变△H保持恒定 | |
| C. | 体系的密度不再发生变化 | |
| D. | 混合气体的平均相对分子质量不再发生变化 |
20.下列关于有机物的说法正确的是( )
①C3H6和C2H4的最简式相同且分子量相差14,所以是同系物
②乙二醇和甲醇含有相同的官能团,所以是同系物
③由乙烯生成乙醇属于加成反应
④苯酚、乙酸乙酯、甲醛的沸点逐渐变低.
①C3H6和C2H4的最简式相同且分子量相差14,所以是同系物
②乙二醇和甲醇含有相同的官能团,所以是同系物
③由乙烯生成乙醇属于加成反应
④苯酚、乙酸乙酯、甲醛的沸点逐渐变低.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
7.某主族元素R的原子核外最外层上有6个电子,其最高价氧化物的化学式为( )
| A. | RO | B. | RO2 | C. | RO3 | D. | RO4 |
4.下列关于胶体的认识错误的是( )
| A. | 河流三角洲的形成与胶体的性质无关 | |
| B. | 清晨在密林中看到的一缕缕光束,是丁达尔现象的表现 | |
| C. | 向沸水中逐滴加入FeCl3溶液并加热至液体呈透明的红褐色,可得氢氧化铁胶体 | |
| D. | 胶体粒子的直径大小在1~100nm之间 |
5.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.对于该反应,下列判断正确的是( )
| A. | 氧化产物与还原产物分子个数之比为15:1 | |
| B. | 氧化剂和还原剂是同一物质 | |
| C. | 反应过程中转移1mol电子,则产生2.24L气体(标准状况) | |
| D. | NaN3中氮元素的化合价为-3 |