题目内容
4.有a、b、c、d、e五种无色气体,进行下列实验:| 实验步骤 | 实验现象 |
| ①a和b相混合 | 气体变为红棕色 |
| ②c和d相混合 | 产生白烟 |
| ③c、e分别通入少量溴水中 | 都变成无色透明的溶液 |
| ④b、e分别通入氢硫酸中 | 都产生淡黄色的浑浊 |
| A. | O2、NO、HCl、NH3、CO2 | B. | O2、NO、NH3、HCl、SO2 | ||
| C. | NO、O2、NH3、HCl、SO2 | D. | HBr、Cl2、NH3、H2S、C2H4 |
分析 由①a和b相混合,气体为红棕色,则生成NO2,a和b中有一种必为NO气体,另一种为O2气体;由②c和d相混合,产生白烟可知,生成固体,则c和d中有一种必为NH3气体,另一种为HCl气体;由③c、e分别通入少量溴水中,均为无色溶液,可知c为NH3,则d为HCl,e为SO2等;由④b、e分别通入氢硫酸中,都产生淡黄色的浑浊,则b为O2,以此来解答.
解答 解:由①a和b相混合,气体为红棕色,则生成NO2,a和b中有一种必为NO气体,另一种为O2气体;
由②c和d相混合,产生白烟可知,生成固体,则c和d中有一种必为NH3气体,另一种为HCl气体;
由③c、e分别通入少量溴水中,均为无色溶液,可知c为NH3,则d为HCl,e为SO2等;
由④b、e分别通入氢硫酸中,都产生淡黄色的浑浊,b、e具有氧化性,则b为O2,e为SO2,可知a为NO,
综上所述,a、b、c、d、e依次可能是NO、O2、NH3、HCl、SO2,
故选C.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
14.下列化学用语中,正确的是( )
| A. | 氮气的电子式: | B. | 镁的离子结构示意图: | ||
| C. | 氯化钠的电子式: | D. | CO2电子式式: |
15.下列说法不正确的是( )
| A. | 酸性氧化物一定是非金属氧化物;金属氧化物一定是碱性氧化物 | |
| B. | 渗析可用于提纯胶体;用丁达尔效应可以鉴别溶液和胶体 | |
| C. | 某元素从游离态变为化合态,该元素可能被氧化,也可能被还原 | |
| D. | SO2的任意排放会形成酸雨,氮氧化物的任意排放会形成光化学烟雾 |
12.实验室制取下列气体时,能用排水法收集的是( )
| A. | H2 | B. | HCl | C. | SO2 | D. | NO2 |
16.如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
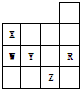

| A. | 常压下五种元素的单质中Z单质的沸点最高 | |
| B. | X和W的常见单质的分子式分别为X2和W2 | |
| C. | W的氢化物沸点比X的氢化物的沸点低 | |
| D. | R最高氧化物水化物的酸性最强 |
13.有6种物质:①乙烷;②乙烯;③苯;④邻二甲苯;⑤聚乙烯;⑥环己烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
| A. | ①③⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | ③④⑤ |
7.(1)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
①实验组i中以v(CO2)表示的反应速率为0.16mol•L-1•min-1,温度升高时平衡常数会减小(填“增大”、“减小”或“不变”).
②若a=2,b=1,则c=0.6,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii (H2O)=αiii (CO)(填“<”、“>”或“=”).
(2)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于
燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-.
①则负极的电极反应式为CO+2O2--2e-=CO32-.
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中消耗一氧化碳的质量为2.8g.
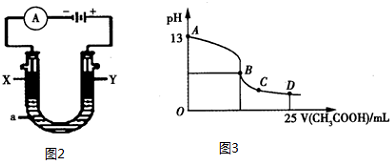
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
②若a=2,b=1,则c=0.6,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii (H2O)=αiii (CO)(填“<”、“>”或“=”).
(2)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于
燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-.
①则负极的电极反应式为CO+2O2--2e-=CO32-.
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中消耗一氧化碳的质量为2.8g.

 某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验.
某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验.