题目内容
12. 砷的一些化合物常用作半导体、除草剂、杀鼠药等.回答下列问题:
砷的一些化合物常用作半导体、除草剂、杀鼠药等.回答下列问题:(1)基态As原子的核外电子排布式为[As]3d104s24p3,有3个未成对电子.
(2)镓氮砷合金材料的太阳能电池效率达40%.Ga、N、As电负性由大至小的顺序是O>Ge>Zn.
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为sp3,1mol As4O6含有σ键的物质的量为12mol.
(4)晶胞有两个基本要素:

①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子
坐标参数A处Li为(0,0,$\frac{1}{2}$);B处As为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{1}{4}$);C处Li的坐标参数为($\frac{1}{2}$,$\frac{1}{2}$,$\frac{1}{2}$).
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数α=594pm,NA表示阿伏加德罗常数的数值,其密度为$\frac{4×147}{(5.94×1{{0}^{-8})}^{3}{N}_{A}}$g•cm-3(列出计算式即可).
分析 (1)As是33号元素,位于第四周期第VA族,基态As原子核外电子排布式为[Ar]3d104s24p3,根据核外电子排布确定未成对电子;
(2)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大;
(3)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4;1个As406分子中含有σ键数目为12个,据此进行分析;
(4)①根据晶胞图结构和A、B、C三个原子的原子坐标,可求出C的原子坐标;
②根据晶胞密度公式:ρ=$\frac{zM}{{N}_{A}V}$可求出密度.
解答 解:(1)As是33号元素,位于第四周期第VA族,基态As原子核外电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3,在最外层的4s能级上2个电子为成对电子,4p轨道中3个电子分别处以不同的轨道内,有3轨道未成对电子,
故答案为:3d104s24p3;3;
(2)锌属于良导体,锗属于半导体,氧属于非金属,所以元素非金属性:O>Ge>Zn,元素的非金属性越强,吸引电子的能力越强,元素的电负性越大,故电负性:O>Ge>Zn,
故答案为:O>Ge>Zn;
(3)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化;1个As406分子中含有σ键数目为12个,故1mol As406含有σ键的物质的量为12mol,
故答案为:sp3;12mol;
(4)①根据晶胞图结构和A、B、C三个原子的原子坐标分别为A处Li为(0,0,$\frac{1}{2}$);B处As为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{1}{4}$),注意在晶体化学中,原子坐标的规则为,每一个坐标的值均在[0,1)之间,且为整数,简言之,1即0,所以A、B、C其实为同一个原子坐标,都可以为(0,0,0),C为体心粒子,其晶胞参数应为$\frac{1}{2}$,其晶胞参数应为:($\frac{1}{2}$,$\frac{1}{2}$,$\frac{1}{2}$),
故答案为:($\frac{1}{2}$,$\frac{1}{2}$,$\frac{1}{2}$);
②立方晶胞顶点原子占$\frac{1}{8}$,面心占$\frac{1}{2}$,棱上占$\frac{1}{4}$,晶胞内部粒子为整个晶胞所有,Li的个数为12×$\frac{1}{4}$+1=4,LiZnAs单晶的晶胞参数α=594pm,则ρ=$\frac{zM}{{N}_{A}V}$=$\frac{4×147}{(5.94×1{{0}^{-8})}^{3}{N}_{A}}$g•cm-3,
故答案为:$\frac{4×147}{(5.94×1{{0}^{-8})}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、化学键、晶胞计算等,(4)中晶胞计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 油脂是高分子化合物 | |
| B. | 氨基酸和蛋白质既能与酸反应,又能与碱反应 | |
| C. | 甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是他们既可以发生水解反应,又可以发生银镜反应 | |
| D. | 蛋白质溶液遇硫酸铜产生的沉淀能重新溶于水 |
| A. | 放电时Pb为负极,此时溶液中的SO42-向Pb电极迁移 | |
| B. | 铅蓄电池电解CuCl2溶液,若制得2.24LCl2(标准状况),这时电池内消耗的H2SO4至少0.2mol | |
| C. | 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极上 | |
| D. | 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
已知:
 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1molH-H键和1molI-I键所需能量大于断开2molH-I键所需能量 | |
| C. | 断开2molH-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2molH2和2molI2,充分反应放出的热量大小2akJ |
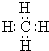 ,AxByCz的分子式AlC3H9.
,AxByCz的分子式AlC3H9.
