题目内容
硫酸铝的电离方程式为: ;锌粒投入稀硫酸中,溶液里 离子的量减少, 离子的量增加, 离子的量没有变化,反应的离子方程式为 .
考点:电离方程式的书写,离子方程式的书写
专题:离子反应专题
分析:硫酸铝是强电解质,溶液中能完全电离出铝离子和硫酸根离子;利用物质的电离理论,结合锌与硫酸的反应对离子的变化情况进行分析,并写出离子方程式;
解答:
解:硫酸铝是强电解质,能完全电离,电离方程式为:Al2(SO4)3═2Al3++3SO42-.
因为锌与硫酸的反应是生成硫酸锌与氢气,硫酸锌是可电离的物质,氢气不可电离,所以对溶液来说氢离子减少,硫酸根离子不变,锌离子增加,反应的离子方程式为:2H++Zn=Zn2++H2↑,
故答案为:Al2(SO4)3═2Al3++3SO42-;H+;Zn2+;SO42-;2H++Zn=Zn2++H2↑;
因为锌与硫酸的反应是生成硫酸锌与氢气,硫酸锌是可电离的物质,氢气不可电离,所以对溶液来说氢离子减少,硫酸根离子不变,锌离子增加,反应的离子方程式为:2H++Zn=Zn2++H2↑,
故答案为:Al2(SO4)3═2Al3++3SO42-;H+;Zn2+;SO42-;2H++Zn=Zn2++H2↑;
点评:本题难度不大,考查电离方程式的书写和锌和硫酸反应的本质,解题的关键是对各相关物质的电离情况的掌握与理解,书写电离方程式时注意离子的正确书写、电荷守恒、离子团不能拆开,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
中和相同体积相同pH值的H2SO4、HCl和CH3COOH三种稀溶液中,所用相同浓度的NaOH溶液的体积为V1、V2和V3,则( )
| A、V3>V1=V2 |
| B、V3>V2>V1 |
| C、V1>V2=V3 |
| D、V1>V2>V3 |
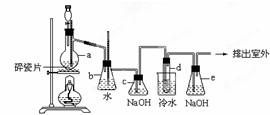 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用下图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白:
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用下图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白: