题目内容
12.已知:Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,Co2O3在酸性溶液中易被还原为Co2+.如果将Co2O3溶于盐酸中,请完成并配平下列的化学方程式,标出电子转移的方向和数目:1Co2O3+6HCl→2CoCl2+1Cl2↑+3H2O
(1)反应物中发生氧化反应的物质是HCl,被还原的元素是Co
(2)每有1mol氧化剂发生反应,起酸性作用HCl的物质的量是4mol.
(3)如果在FeCl2、HI的混合液中逐渐加入Co2O3,被氧化的离子先后顺序是:I->Fe2+>Cl-.
分析 (1)依据Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,可知Co2O3能够氧化氯化氢生成氯气,分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒规律配平方程式;
(2)依据方程式判断氯化氢表现的性质;
(3)氧化还原反应先后规律:同一种氧化剂与多种还原剂反应,先与还原性强的反应.
解答 解:(1)依据Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,可知Co2O3能够氧化氯化氢生成氯气,反应中Co2O3中+3价的钴在酸性溶液中易被还原为Co2+,则氯化氢中-1价的氯被氧化为氯气中0价的氯,要使化合价升降数目相等,则Co2O3系数为1,被氧化的氯化氢物质的量为1mol,依据原子个数守恒,生成2molCoCl2,1mol氯气,则消耗氯化氢物质的量为6mol,生成水3mol,方程式为:1Co2O3+6HCl→2COCl2+1Cl2+3H2O,反应中氯化氢被氧化,Co被还原;
故答案为:1;6; 2COCl2;1Cl2↑;3H2O;HCl;Co;
(2)依据方程式1Co2O3+6HCl→2COCl2+1Cl2+3H2O,可知参加反应的氯化氢物质的量为6mol,其中有2molCl-化合价升高,HCl表现为还原性,有4molHCl与生成的Co2+结合生成2COCl2,表现为酸性,
故答案为:4;
(3)Cl2、FeCl3、I2的氧化性依次减弱,可知还原性由强到弱的顺序为:I->Fe2+>Cl-,依据氧化还原反应先后规律可知,在FeCl2、HI的混合液中逐渐加入Co2O3,被氧化的离子先后顺序是:I->Fe2+>Cl-,
故答案为:I->Fe2+>Cl-.
点评 本题为综合题,考查了氧化还原反应配平等,熟悉氧化还原反应得失电子守恒、原子个数守恒规律,明确氧化还原反应先后规律是解题关键,题目难度中等.

| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s 的平均速率 (PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时 (PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前 (正)>(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
| A. | 石墨与金刚石 | B. |  与 与  | C. |  与 与  | D. |  与 与 |
| A. | 称量NaOH固体时,放在烧杯中且称量较慢 | |
| B. | 定容时,俯视刻度线 | |
| C. | 定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出 | |
| D. | 移液前,容量瓶中有少量蒸馏水 |
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
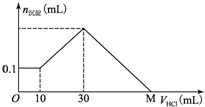 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )| A. | 70 mL | B. | 100 mL | C. | 120 mL | D. | 130 mL |
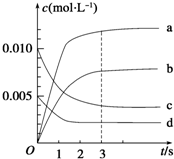 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是b,
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是ac
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
| A. | CaCO3→CO2 | B. | Cl2→HClO | C. | Na→Na+ | D. | Fe3+→Fe2+ |
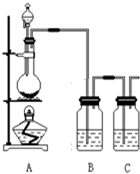 为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:
为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题: