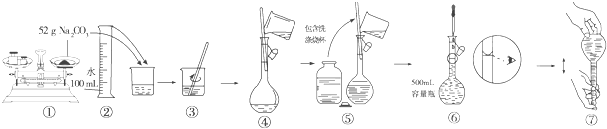
题目内容
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.
完成下列填空:
(1)写出上述制备小苏打的化学方程式.
(2)称取1.840g 苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml.实验中所需的定量仪器除滴定管、电子天平外,还有 .样品中NaHCO3的质量分数为 .(保留3个有效数字)
(3)不规范的实验操作会导致实验结果的误差.分析下列操作对实验结果的影响 (选填“偏 高”、“偏低”或“无影响”)
①定容时仰视仪器上的刻度线 ;
②定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线 .
③将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 .
完成下列填空:
(1)写出上述制备小苏打的化学方程式.
(2)称取1.840g
(3)不规范的实验操作会导致实验结果的误差.分析下列操作对实验结果的影响 (选填“偏 高”、“偏低”或“无影响”)
①定容时仰视仪器上的刻度线
②定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
③将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),根据质量守恒可知同时生成NH4Cl;
(2)配制溶液需要容量瓶,根据盐酸的物质的量可确定碳酸氢钠的质量,进而可计算质量分数;
(3)根据C=
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
(2)配制溶液需要容量瓶,根据盐酸的物质的量可确定碳酸氢钠的质量,进而可计算质量分数;
(3)根据C=
| n |
| V |
解答:
解:(1)饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),根据质量守恒可知同时生成NH4Cl,反应的方程式为NH4HCO3+NaCl=NaHCO3↓+NH4Cl,
故答案为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
(2)配成250mlNaHCO3溶液,用到的仪器有电子天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以所需的定量仪器除滴定管、电子天平外,还有250ml容量瓶;
消耗盐酸的物质的量n(HCl)=0.0215L×0.1000mol/L=0.00215mol,
则25mL溶液中n(NaHCO3)=0.00215mol,
所以样品中m(NaHCO3)=0.00215mol×10×84g/mol=1.806g,
ω(NaHCO3)=
=98.2%=0.982,故答案为:250mL容量瓶;0.982;
(3)①定容时仰视仪器上的刻度线,会导致溶液体积偏大,溶液浓度偏低,故答案为:偏低;
②定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线是正常的,又加入少量水至刻度线会导致溶液浓度偏低,故答案为:偏低;
③如全被为碳酸氢钠,与盐酸反应后生成氯化钠,质量减小,而如全部为氯化钠时,质量基本不变,可知加热后固体质量越小,碳酸氢钠含量越大,则若蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高,故答案为:偏高.
故答案为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
(2)配成250mlNaHCO3溶液,用到的仪器有电子天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以所需的定量仪器除滴定管、电子天平外,还有250ml容量瓶;
消耗盐酸的物质的量n(HCl)=0.0215L×0.1000mol/L=0.00215mol,
则25mL溶液中n(NaHCO3)=0.00215mol,
所以样品中m(NaHCO3)=0.00215mol×10×84g/mol=1.806g,
ω(NaHCO3)=
| 1.806g |
| 1.840g |
(3)①定容时仰视仪器上的刻度线,会导致溶液体积偏大,溶液浓度偏低,故答案为:偏低;
②定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线是正常的,又加入少量水至刻度线会导致溶液浓度偏低,故答案为:偏低;
③如全被为碳酸氢钠,与盐酸反应后生成氯化钠,质量减小,而如全部为氯化钠时,质量基本不变,可知加热后固体质量越小,碳酸氢钠含量越大,则若蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高,故答案为:偏高.
点评:本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
如果1g水中含有n个氢原子,则阿伏加德罗常数的值为( )
| A、18n | B、9n |
| C、2n | D、n/9 |
化学与环境、生产和生活密切相关.下列说法错误的是( )
| A、化肥的合理使用,缓解了人类粮食危机 |
| B、绿色化学的快速发展,减轻了环境污染 |
| C、新材料的研制和应用,提高了人们的生活品质 |
| D、化石燃料的直接利用,促进了“低碳”经济的发展 |
完成下列实验所选择的试剂、装置或仪器(夹持装置已略去)正确的是( )
| A.吸收NH3,并防止倒吸用 | B.除去自来水中的Fe3+获得纯净水 | C.从KI和I2的固体混合物中回收I2 | D.苯提取溴水中的Br2 |
 |  |  |  |
| A、A | B、B | C、C | D、D |
要增大铁与盐酸反应的速率,所采取的下列措施中无效的是( )
| A、用铁粉代替铁片 |
| B、增大压强 |
| C、提高反应的温度 |
| D、增大盐酸的浓度 |
下列实验设计方案,可行的是( )
| A、检验CO32-,可取少量试剂滴加稀盐酸,若产生无色无味的气体能使澄清石灰水变浑浊,则说明原溶液中一定有CO32- |
| B、检验SO42-,可取少量试剂滴加氯化钡溶液,若产生白色沉淀,则说明原溶液中有SO42- |
| C、用氢氧化钠溶液可除去CO2气体中的HCl气体 |
| D、为除去粗盐中的Ca2+、Mg2+、SO42-可依次加入过量的BaCl2、NaOH、Na2CO3后过滤,再加入适量的稀盐酸 |
下列各组无色溶液中,所含离子能大量共存的是( )
| A、K+ Na+ Cl- NO3- |
| B、Cu2+ H+ HCO3- Cl- |
| C、Na+ Ba2+ Cl- SO42- |
| D、Fe2+ H+ NO3- ClO- |