题目内容
14.11.5g Na 与足量的水反应生成氢氧化钠和H2.请计算:(1)参加反应的钠的物质的量为多少 mol?
(2)生成标准状况下氢气的体积为多少升?
(3)把所得溶液稀释到500ml后溶液的物质的量浓度为多少?
分析 (1)根据n=$\frac{m}{M}$计算钠的物质的量;
(2)发生反应:2Na+2H2O═2NaOH+H2↑,根据方程式计算生成氢气物质的量,再根据V=nVm计算氢气体积;
(3)根据钠原子守恒可知n(NaOH)=n(Na),再根据c=$\frac{n}{V}$计算稀释后溶液物质的量浓度.
解答 解:(1)11.5g钠的物质的量为$\frac{11.5g}{23g/mol}$=0.5mol,
答:参加反应钠的物质的量为0.5mol;
(2)由2Na+2H2O═2NaOH+H2↑,可知n(氢气)=$\frac{1}{2}$n(Na)=$\frac{0.5mol}{2}$=0.25mol,故生成氢气体积为0.25mol×22.4L/mol=5.6L,
答:标况下生成氢气为5.6L;
(3)根据钠原子守恒可知n(NaOH)=n(Na)=0.5mol,稀释后溶液物质的量浓度为$\frac{0.5mol}{0.5L}$=1mol/L,
答:稀释到500mL后溶液的物质的量浓度为1mol/L.
点评 本题考查化学方程式的有关计算、物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列叙述正确的是( )
| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 乙醇可以被氧化为乙酸,二者均能发生取代、氧化反应 | |
| C. | 甲烷、乙烯和苯在工业上都可通过石油分馏或裂化得到 | |
| D. | 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
2.下列关于实验安全的说法正确的是( )
| A. | 化学实验室不必备有灭火器等防火器材 | |
| B. | 稀释浓硫酸时要把浓硫酸慢慢注入水中且不断搅拌 | |
| C. | 化学实验室空间较小,易燃易爆物跟其他物质可混存 | |
| D. | 一切能产生有毒气体的实验均不能在实验室中进行 |
19.下列叙述正确的是( )
| A. | 预测PCl3的立体构型为平面三角形 | |
| B. | SO2和CO2都是含有极性键的非极性分子 | |
| C. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| D. | 铝元素的原子核外共有5种不同运动状态的电子 |
3.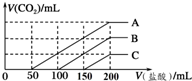 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 通入CO2后,A烧杯中的溶质成分是Na2CO3 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 原NaOH溶液的浓度为0.2 mol/L | |
| D. | 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:2 |
4.部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HA | HB | H2C |
| 电离平衡常数 (25℃) | K1=1.77×10-4 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | B-+HA→HB+A- | |
| B. | 2Bˉ+H2C→2HB+C2- | |
| C. | 中和等体积、等pH的HA和HB消耗NaOH的量前者小于后者 | |
| D. | 等体积、等浓度的NaA和NaB溶液中所含离子总数前者大于后者 |


