题目内容
14.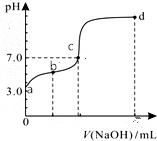 常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( )
常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( )| A. | 由题可知HA为弱酸 | |
| B. | 滴定终点位于c和d点之间 | |
| C. | 滴定到b点时:n(Na+)+n(H+)-n(OH-)+n(HA)=0.002mol | |
| D. | 滴定到d点时:c(OH-)>c(Na+)>c(A-)>c(H+) |
分析 A、20mL0.1mol/LHA溶液pH=3,所以酸是弱酸;
B、酸为弱酸,恰好中和时溶液呈碱性,pH>7,溶液呈中性,需要酸稍过量;
C、任何溶液一定满足电荷守恒,b点溶液显酸性,析根据电荷守恒、物料守恒进行判断;
D、根据氢氧化钠和醋酸钠溶液中离子浓度的大小关系来回答.
解答 解:A、20mL0.1mol/LHA溶液pH=3,所以酸是弱酸,故A正确;
B、向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,恰好中和时溶液呈碱性,pH>7,溶液呈中性,需要酸稍过量,滴定终点位于c和b点之间,故B错误;
C、滴定到b点时,根据电荷守恒:n(Na+)+n(H+)-n(OH-)=n(A-),n(A-)+n(HA)=0.002mol,即n(Na+)+n(H+)-n(OH-)+n(HA)=0.002mol,故C正确;
D、d点所的溶液是氢氧化钠和NaA溶液的混合物,c(Na+)>c(A-),氢氧化钠剩余,c(Na+)>c(OH-)>c(A-)>c(H+),故D错误,
故选BD.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,能够根据电荷守恒、物料守恒比较溶液中离子浓度大小.

练习册系列答案
相关题目
6.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA | |
| B. | 常温下,14g C2H4和C3H6的混合气体中含有2NA个氢原子 | |
| C. | 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA | |
| D. | 在含有4molSi-O键的石英晶体中,氧原子的数目为4 NA |
5.现有9.4gCaCO3和K2CO3的固体混合物,测得其中含有氧元素的质量为3.6g,将该混合物与100g稀盐酸混合,恰好完全反应.则最后所得不饱和溶液的质量为( )
| A. | 105g | B. | 106.1g | C. | 107.6g | D. | 108.3g |
2.常温下,物质的量浓度相同的三种盐NaX、NaY和NaZ溶液的pH依次为8、9、10,则下列表达式错误的是( )
| A. | Z-+H2O?HZ+OH- | B. | HY?H++Y- | ||
| C. | 常温下,电离程度:HX>HY>HZ | D. | Z-+HX?HZ+X- |
17.下列说法正确的是( )
| A. | 全部由非金属元素组成的化合物一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 硫酸分子中有H+和SO42-两种离子 |
 ①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。
①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。 NO2分子
NO2分子