题目内容
14.下列图示与对应的叙述相符的是( )
| A. | 图1所示,从能量角度考虑,石墨比金刚石稳定 | |
| B. | 图2表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+ | |
| C. | 图3所示,图中的阴影部分面积的含义是(v正-v逆) | |
| D. | 图4表示0.001 mol•L-1盐酸滴定0.001 mol•L-1NaOH溶液的滴定曲线 |
分析 A、物质的能量越低越稳定;
B、a点所示pH接近12,碱性环境中铝离子会生成氢氧化铝沉淀;
C、图中阴影部分的面积为[c(反应物)-c (生成物)];
D、反应终点的pH应为7.
解答 解:A、从图上可知,石墨能量比金刚石低,石墨稳定,故A正确;
B、a点所示pH接近12,碱性环境中铝离子会生成氢氧化铝沉淀,故B错误;
C、图中阴影部分的面积为[c(反应物)-c (生成物)],故C错误;
D、反应终点的pH应为7不为6,故D错误;
故选A.
点评 本题考查了据图分析中和滴定中的pH变化、物质的能量越低越稳定、铝离子的存在、正逆反应速率变化图线及含义,题目难度较大.

练习册系列答案
相关题目
18.标准状况下,与3g H2体积相等的N2的( )
| A. | 质量为3g | B. | 物质的量为1.5mol | ||
| C. | 体积为22.4L | D. | 含有的N原子数约为3NA |
5.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$,△H<0(填“>”、“<”或“=”).
②按下列物质的量发生反应,CO的转化率由大到小的顺序是甲>丙>乙(填甲乙丙).
(2)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)═2CO2(g) K2
③H2O(g)═H2O(l) K3
④CH3OH(l)+O2(g)═CO(g)+2H2O(l)K4
则K4=$\frac{{{K}_{1}}^{\frac{1}{2}}•{{K}_{3}}^{2}}{{{K}_{2}}^{\frac{1}{2}}}$(用含有K1,K2,K3的代数式表达)
2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②按下列物质的量发生反应,CO的转化率由大到小的顺序是甲>丙>乙(填甲乙丙).
| 编号 | C(H2)mol/L | C(CO)mol/L |
| 甲 | 2 | 1 |
| 乙 | 1 | 2 |
| 丙 | 1 | 1 |
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)═2CO2(g) K2
③H2O(g)═H2O(l) K3
④CH3OH(l)+O2(g)═CO(g)+2H2O(l)K4
则K4=$\frac{{{K}_{1}}^{\frac{1}{2}}•{{K}_{3}}^{2}}{{{K}_{2}}^{\frac{1}{2}}}$(用含有K1,K2,K3的代数式表达)
9.化学无处不在,下列与化学知识有关的说法不正确的是( )
| A. | 可用三氯化铝对自来水进行杀菌消毒 | |
| B. | 热的纯碱溶液可用于去油污 | |
| C. | 利用中和滴定原理可测定NaOH和NaCl混合液中NaCl的含量 | |
| D. | 用氯化铵浓溶液可除去铁器表面的铁锈 |
6.等质量的氯气与下列足量物质反应,转移的电子数最少的是( )
| A. | SO2的水溶液 | B. | FeCl2溶液 | C. | 冷的NaOH溶液 | D. | Cu |
3.下列说法正确的是( )
| A. | 平衡膳食就是各种食物都要吃 | |
| B. | 摄入食物中的营养素种类齐全,数量充足,比例适当且与人体的需要的保持平衡才是合理的膳食结构 | |
| C. | 淀粉、油脂、蛋白质为人体提供热能,所以只要这三种摄入量足够就可以了 | |
| D. | 麦芽糖不可以水解 |
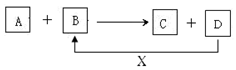 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.