题目内容
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶.制备它的一种配方中含有下列四种物质:

(1)丙的名称是 ;乙中官能团的名称是 .
(2)写出甲和丙聚合得到高聚物的结构简式 .
(3)化合物丁的分子式为C6H6O2,只含两种化学环境的氢原子,遇FeCl3溶液呈现特征颜色.写出丁与足量碳酸钠溶液反应的化学方程式 .
(4)下列试剂中与上述四种物质都能发生反应的是 (填写编号).
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液 d.O2
(5)写出实验室由 制备比
制备比 少2个氢原子的芳香烃的合成路线 .合成路线流程图示例如下:CH3CH2OH
少2个氢原子的芳香烃的合成路线 .合成路线流程图示例如下:CH3CH2OH
CH2H2C
CH2BrBrH2C.

(1)丙的名称是
(2)写出甲和丙聚合得到高聚物的结构简式
(3)化合物丁的分子式为C6H6O2,只含两种化学环境的氢原子,遇FeCl3溶液呈现特征颜色.写出丁与足量碳酸钠溶液反应的化学方程式
(4)下列试剂中与上述四种物质都能发生反应的是
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液 d.O2
(5)写出实验室由
 制备比
制备比 少2个氢原子的芳香烃的合成路线
少2个氢原子的芳香烃的合成路线| 浓硫酸 |
| 170℃ |
| Br2 |
考点:有机物的合成,有机物分子中的官能团及其结构
专题:有机物的化学性质及推断
分析:(1)丙中含苯环和乙烯基,乙中含-OH;
(2)甲和丙聚合得到高聚物,发生加聚反应;
(3)丁的分子式为C6H6O2,只含两种化学环境的氢原子,遇FeCl3溶液呈现特征颜色,则丁为对二苯酚,与碳酸钠反应生成酚钠和碳酸氢钠;
(4)碳碳双键、-OH均能被高锰酸钾氧化,四种物质均可燃烧;
(5)由 制备比
制备比 少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应.
少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应.
(2)甲和丙聚合得到高聚物,发生加聚反应;
(3)丁的分子式为C6H6O2,只含两种化学环境的氢原子,遇FeCl3溶液呈现特征颜色,则丁为对二苯酚,与碳酸钠反应生成酚钠和碳酸氢钠;
(4)碳碳双键、-OH均能被高锰酸钾氧化,四种物质均可燃烧;
(5)由
 制备比
制备比 少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应.
少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应.解答:
解:(1)丙中含苯环和乙烯基,名称为苯乙烯,乙中含-OH,名称为羟基,故答案为:苯乙烯;羟基;
(2)加丙发生加成反应生成高聚物的结构简式为 ,故答案为:
,故答案为: ;
;
(3)丁的分子式为C6H6O2,只含两种化学环境的氢原子,遇FeCl3溶液呈现特征颜色,则丁为对二苯酚,丁与足量碳酸钠溶液反应的化学方程式为 +2Na2CO3→
+2Na2CO3→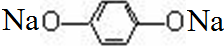 +2NaHCO3,
+2NaHCO3,
故答案为: +2Na2CO3→
+2Na2CO3→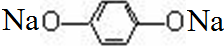 +2NaHCO3;
+2NaHCO3;
(4)甲乙丙不与石蕊反应,乙不与溴反应,碳碳双键、-OH均能被高锰酸钾氧化,四种物质均可燃烧,则c d均可与上述物质反应,故答案为:cd;
(5)由 制备比
制备比 少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应,合成流程为
少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应,合成流程为 ,
,
故答案为: .
.
(2)加丙发生加成反应生成高聚物的结构简式为
 ,故答案为:
,故答案为: ;
;(3)丁的分子式为C6H6O2,只含两种化学环境的氢原子,遇FeCl3溶液呈现特征颜色,则丁为对二苯酚,丁与足量碳酸钠溶液反应的化学方程式为
 +2Na2CO3→
+2Na2CO3→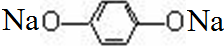 +2NaHCO3,
+2NaHCO3,故答案为:
 +2Na2CO3→
+2Na2CO3→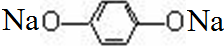 +2NaHCO3;
+2NaHCO3;(4)甲乙丙不与石蕊反应,乙不与溴反应,碳碳双键、-OH均能被高锰酸钾氧化,四种物质均可燃烧,则c d均可与上述物质反应,故答案为:cd;
(5)由
 制备比
制备比 少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应,合成流程为
少2个氢原子的芳香烃苯乙炔,可先加成生成醇、再消去生成苯乙烯,再与溴水加成,最后发生消去反应,合成流程为 ,
,故答案为:
 .
.
点评:本题考查有机物合成及结构与性质,为高考常见题型,注意结构中的官能团,侧重合成流程及官能团与性质的考查,(5)中合成流程为解答的易错点,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
为把溴水中溴单质萃取出来,应加入( )
| A、苯 | B、苯酚溶液 | C、乙醇 | D、乙醛 |
下列化工生产过程中发生的反应,不属于氧化还原反应的是( )
| A、用氨气制硝酸 |
| B、用石灰石制生石灰 |
| C、用氯气制漂白粉 |
| D、从卤水中提取溴单质 |
 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )| A、X电极是阴极 |
| B、Y电极产生气体的体积为0.224L |
| C、电解后溶液的pH=1 |
| D、要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 |
 而不是
而不是 ,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是
,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是 某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: