题目内容
8.下列性质递变不正确的是( )| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 半径:Cl->Na+>F- | ||
| C. | 热稳定性:HF>H2O>PH3 | D. | 还原性:Cl-<Br-<I- |
分析 A、元素的非金属性越强,则最高价含氧酸的酸性越强;
B、电子层数越多,半径越大;当电子层数相同时,核电荷数越多,半径越小;
C、元素的非金属性越强,则气态氢化物的热稳定性越强;
D、元素的非金属性越强,则阴离子的还原性越弱.
解答 解:A、元素的非金属性越强,则最高价含氧酸的酸性越强,由于非金属性Cl>S>P,故最高价含氧酸的酸性HClO4>H2SO4>H3PO4,故A正确;
B、Cl-的核外有3个电子层,而Na+、F-的核外有2个电子层,而电子层数越多,半径越大,故Cl-的半径最大;Na+、F-的核外有2个电子层,而当电子层数相同时,核电荷数越多,半径越小,故Na+的半径最小,故半径大小应为Cl->F->Na+,故B错误;
C、元素的非金属性越强,则气态氢化物的热稳定性越强,由于非金属性F>O>P,故热稳定性:HF>H2O>PH3,故C正确;
D、元素的非金属性越强,则阴离子的还原性越弱,由于非金属性Cl>Br>I,故阴离子的还原性Cl-<Br-<I-,故D正确.
故选B.
点评 本题考查了元素周期律的应用,应注意的是元素非金属性强弱比较的方法,难度不大,注意基础知识的掌握.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
15.分子式为C4H10O的有机物含有-CH2OH基团的同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.下列说法正确的是( )
| A. | 物质的量就是物质的数量 | |
| B. | Mg2+的摩尔质量为24g/mol | |
| C. | 标准状况下,22.4L水的物质的量为1mol | |
| D. | 80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L |
16.下列关于烷烃与烯烃的说法中正确的是( )
| A. | 烯烃的含碳量一定高于烷烃 | |
| B. | 烷烃分子中只含有碳碳单键,烯烃分子中只含有碳碳双键 | |
| C. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| D. | 相同条件下,烷烃的沸点一点高于烯烃 |
3.下列反应中,反应物的用量或浓度改变时,不会改变生成物的是( )
| A. | 铜与硝酸反应 | B. | 明矾溶液与烧碱溶液反应 | ||
| C. | 碳酸钠溶液和盐酸反应 | D. | 硫在氧气中燃烧 |
13.中药的煎制直接关系到其疗效.下列中草药煎制步骤中,属于过滤操作的是( )
| A. |  冷水浸泡 | B. |  加热煎制 | C. |  箅渣取液 箅渣取液 | D. |  灌装保存 |
20.下列化工生产中未使用催化剂的是( )
| A. | 索尔维制碱法 | B. | 合成氨 | C. | 乙烯水化 | D. | SO2转化为SO3 |
18.某反应A(g)+B(g)?C(g)的能量变化如图所示,由图象可知,加入X后( )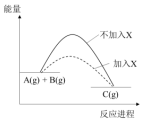

| A. | 反应速率增大 | B. | 反应物转化率增大 | ||
| C. | 生成物的能量降低 | D. | 反应的热效应降低 |



