题目内容
6.盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性.现在有如下三个反应,有关判断正确的是( )①Zn+2HCl═ZnCl2+H2↑
②NaOH+HCl═NaCl+H2O
③2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑
| A. | 反应①是置换反应,HCl表现还原性 | |
| B. | 反应②是复分解反应,HCl表现氧化性 | |
| C. | 反应③中HCl既有氧化性也有还原性 | |
| D. | 反应①中氧化剂和氧化产物的物质的量之比是1:1 |
分析 ①为置换反应,反应中HCl的H元素的化合价降低,Zn元素化合价升高;②为中和反应,元素化合价不变;③2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑H元素的化合价降低,Cl元素的化合价升高,以此解答该题.
解答 解:A.反应①中HCl的H元素的化合价降低,HCl表现氧化性,故A错误;
B.反应②是复分解反应,元素化合价没有变化,HCl表现酸性,故B错误;
C.2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑H元素的化合价降低,Cl元素的化合价升高,HCl既有氧化性也有还原性,故C正确;
D.反应①中氧化剂和氧化产物的物质的量之比是2:1,故D错误.
故选C.
点评 本题考查了氧化还原反应,侧重于物质氧化性和还原性判断的考查,明确基本概念内涵是解本题关键,根据元素化合价是否变化来分析解答,难度不大.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 1mol化合物 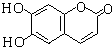 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等 | |
| B. | 等质量的乙醇、乙烯、甲烷分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 聚乳酸(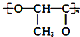 )是由单体之间通过加聚反应合成的 )是由单体之间通过加聚反应合成的 | |
| D. | 实验证实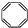 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键 |
11.已知钍90232Th的原子可发生下列放射性变化:90232Th→88228X+24He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断正确的是( )
| A. | X原子核外有6个电子层 | B. | X的碳酸正盐不溶于水 | ||
| C. | X的最高化合价为+3价 | D. | X的氢氧化物是一种弱碱 |
7.镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成,放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究.
已知:①NiCl4易溶于水,Fe2+不能氧化Ni2+.
②某温度下一些金属氢氧化物的KSP及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-.
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+,过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5 mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
已知:①NiCl4易溶于水,Fe2+不能氧化Ni2+.
②某温度下一些金属氢氧化物的KSP及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | KSP | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-52 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-38 | 5.9 | 8.9 |
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-.
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+,过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5 mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
4.化学与生活息息相关,下列说法错误的是( )
| A. | 用SO2漂白过的草帽辫日久会变色 | |
| B. | 硅胶多孔,常用作食品干燥剂和催化剂的载体 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 氯气处理饮用水,在夏季的杀菌效果比在冬季好 |

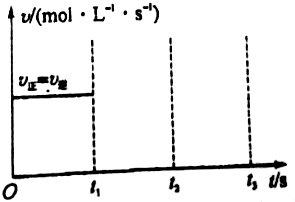 工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.
工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.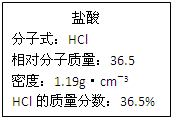 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据