题目内容
2.某烷烃相对分子质量为86,若该分子中仅含有3个甲基(-CH3),则其一氯取代物最多有( )种(不考虑立体异构)| A. | 7 | B. | 8 | C. | 9 | D. | 10 |
分析 烷烃相对分子质量为86,则该烷烃含有的碳原子数目=$\frac{86-2}{14}$=6,该烷烃为己烷;若该分子中仅含有3个甲基(-CH3),说明该烷烃只含有1个支链,其支链不可能为乙基,只能是甲基,该有机物可能的结构简式有2种:CH3CH(CH3)CH2CH2CH3、CH3CH2CH(CH3)CH2CH3,然后根据这两种有机物分子中含有的不同位置的H的数目判断其一氯代物种类.
解答 解:某烷烃相对分子质量为86,则该烷烃中含有碳原子数目=$\frac{86-2}{14}$=6,为己烷;若该分子中仅含有3个甲基(-CH3),则该己烷分子中只能含有1个支链甲基,不会含有乙基,其主链含有5个C,满足条件的己烷的结构简式为:①CH3CH(CH3)CH2CH2CH3,②CH3CH2CH(CH3)CH2CH3,其中①分子中含有5种位置不同的H,即含有一氯代物的数目为5;②分子中含有4种位置不同的H,则其一氯代物有4种,所以该结构的烃的一氯取代物最多可能有:5+4=9种,
故选C.
点评 本题考查了同分异构体的求算,题目难度中等,注意掌握同分异构体的根据及求算方法与技巧,正确理解题干信息为解答本题的关键.

练习册系列答案
相关题目
12.同温同压下,某容器充满氧气时重116g,若充满CO2时重122g.现充满X气体时重114g,则X气体不可能是( )
| A. | CO | B. | N2 | C. | C2H4 | D. | HCl |
10.下列除去杂质的方法不正确的是( )
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 用加热的方法出去苏打中少量的小苏打 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
17.下列关于有机化合物的说法错误的是( )
| A. | 己烷有4种同分异构体,它们的熔沸点不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐增大 | |
| D. | 聚合物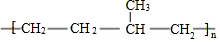 由单体CH3CH=CH2和CH2=CH2加聚制得 由单体CH3CH=CH2和CH2=CH2加聚制得 |
7. 某兴趣小组设计简易原电池装置如图所示,该电池工作时,下列说法正确的是( )
某兴趣小组设计简易原电池装置如图所示,该电池工作时,下列说法正确的是( )
 某兴趣小组设计简易原电池装置如图所示,该电池工作时,下列说法正确的是( )
某兴趣小组设计简易原电池装置如图所示,该电池工作时,下列说法正确的是( )| A. | 锌片做正极 | B. | 碳棒上有气泡产生 | ||
| C. | 可将电能转化为化学能 | D. | 电子由碳棒经导线流向锌片 |
14.正确认识铁制品的电化学腐蚀与防护方法的是( )
| A. | 铁制品腐蚀时既可作正极也可作负极 | |
| B. | 铁制品腐蚀时铁电极发生反应为:Fe-3e-=Fe2+ | |
| C. | 铁制品腐蚀时或发生析氢腐蚀或发生吸氧腐蚀 | |
| D. | 铁制品连接电源正极可防止腐蚀 |
15.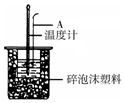 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如图所示,仪器A的名称是环形玻璃搅拌棒;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H>-57.3KJ/mol(填“>”、“<”或“=”);
(3)根据上表中所测数据进行计算(近似认为盐酸和NaOH溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•g-1•℃-1),则中和热△H=-56.8kJ/mol (取小数点后一位).
(4)若某同学利用如图装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如图所示,仪器A的名称是环形玻璃搅拌棒;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H>-57.3KJ/mol(填“>”、“<”或“=”);
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(4)若某同学利用如图装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.