题目内容
17.按要求完成以下化学方程式:(1)配平:1Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
其中氧化剂是Fe2O3,氧化产物是CO2.
(2)用单线桥法标出电子转移方向和数目:
Zn+CuSO4═ZnSO4+Cu
(3)用双线桥法标出电子转移方向和数目:8NH3+3Cl2═6NH4Cl+N2.
分析 (1)根据质量守恒定律:反应前后各原子的数目不变,选择相应的配平方法(最小公倍数法、定一法等)进行配平即可;
(2)由氧化还原反应中单线桥的表示方法,可知箭头从还原剂出发指向氧化剂,在横线上标出转移的电子数目即可;
(3)反应8NH3+3Cl2═6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,该反应中转移6e-,以此来解答.
解答 解:(1)Fe2O3中Fe:+3→0降3价Fe2O3参加反应降6价,CO中C:+2→0降2价,根据化合价升降相等,Fe2O3前配1,CO前配3,根据C元素守恒CO2前配3,根据Fe元素守恒Fe前配2,所以反应方程式为,Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2,Fe2O3中Fe化合价降低作氧化剂,产物CO2中C元素化合价升高是氧化产物,
故答案为:1;3;2;3;Fe2O3;CO2;
(2)反应中Zn化合价从0→+2失去2e-,CuSO4中Cu从+2→0得到2e-,用单线桥表示氧化还原反应: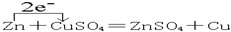 ,
,
故答案为: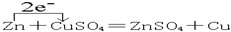 ;
;
(3)8NH3+3Cl2═6NH4Cl+N2,反应中8个NH3中2个被氧化,N:-3→0,升3价2个升6价失去6e-,Cl2中Cl:0→-1降1价,一个氯分子得到2e-,参加反应的3个氯气分子得到6e-,用双线桥标出电子转移的方向和数目可为 ,故答案为:
,故答案为: .
.
点评 根据题目信息,找出反应物和生成物,再利用书写化学方程式的方法及步骤,根据质量守恒定律,正确书写化学方程式,学会利用氧化还原分析氧化剂、还原剂、氧化产物、还原产物,能够运用单线桥和双线桥表示电子转移的方向和数目,题目比较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列关于0.5molO2的说法不正确的是( )
| A. | 含有0.5个氧分子 | B. | 摩尔质量是32g/mol | ||
| C. | 含有3.01×1023个氧分子 | D. | 质量是16g |
1.下列关于弱电解质的电离平衡常数的叙述中,正确的是( )
| A. | 因为电离过程是吸热过程,所以温度越高,同一弱电解质的电离平衡常数越大,电离度越小 | |
| B. | 弱电解质的电离平衡常数是由各微粒的平衡浓度表达的,所以弱电解质的电离平衡常数只与浓度有关 | |
| C. | 对于不同的弱酸,电离平衡常数越大,酸性一定越强,可以通过电离平衡常数的大小判断弱酸的相对强弱 | |
| D. | 弱电解质的电离平衡常数是衡量弱电解质电离程度大小的一种方法 |
5.新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成Fe3O4.甲同学用图1所示装置进行纳米级铁粉与水蒸气反应的实验:
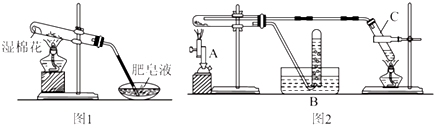
(1)该装置中纳米级铁粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;高温\;}}{\;}$FeO+H2.
乙同学用图2所示装置进行纳米级铁粉与水蒸气的反应并验证产物:
(2)装置C的作用是制取水蒸气.
(3)酒精灯和酒精喷灯都是实验室常用的加热仪器,在该实验中应先点燃酒精灯.
(4)不能撤除收集气体产物装置B的原因是氢气遇明火可能发生爆炸.
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
乙同学认为该条件下反应的固体产物为FeO.丙同学认为该结论不正确,他的理由是Fe+2H+═2Fe2++H2↑,2Fe3++Fe═3Fe2+(用离子方程式表示).
(6)丁同学称取5.60 g铁粉,用图2所示装置反应一段时候后,停止加热.将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3 0.08 mol.则丁同学所做实验的固体产物为Fe3O4.

(1)该装置中纳米级铁粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;高温\;}}{\;}$FeO+H2.
乙同学用图2所示装置进行纳米级铁粉与水蒸气的反应并验证产物:
(2)装置C的作用是制取水蒸气.
(3)酒精灯和酒精喷灯都是实验室常用的加热仪器,在该实验中应先点燃酒精灯.
(4)不能撤除收集气体产物装置B的原因是氢气遇明火可能发生爆炸.
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后的黑色粉末X(假定成分分布均匀)取出少量,放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
(6)丁同学称取5.60 g铁粉,用图2所示装置反应一段时候后,停止加热.将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3 0.08 mol.则丁同学所做实验的固体产物为Fe3O4.
12.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
2.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率分别如下,其中反应速率最大的是( )
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.35mol•L-1•min-1 | D. | vD=0.02mol•L-1•s-1 |
 .
.