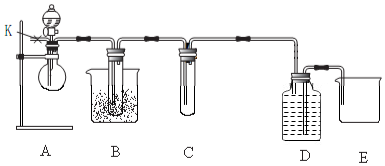
题目内容
20.把2.5mol A和2.5mol B混合放入2L密闭容器里,发生反应:3A(g)+B(g)???xC(g)+2D(g),经5s后反应达平衡.在此5s内C的平均反应速率为0.2mol/(L•s),同时生成1mol D.试求:(1)达平衡时A的浓度是0.5mol/L;
(2)达平衡时B的转化率是20%;
(3)x的值是4;
(4)若温度不变,达平衡时容器内气体的压强是反应前的1.2倍.
分析 经5s后反应达平衡.在此5s内C的平均反应速率为0.2mol/(L•s),同时生成1mol D,v(D)=$\frac{\frac{1mol}{2L}}{5s}$=0.1mol/(L•s),由反应速率之比等于化学计量数之比可知x=4,则
3A(g)+B(g)???4C(g)+2D(g)
开始 2.5 2.5 0 0
转化 1.5 0.5 2 1
平衡 1 2 2 1
结合c=$\frac{n}{V}$、转化率=$\frac{转化的量}{开始的量}$×100%、物质的量比等于压强比计算.
解答 解:经5s后反应达平衡.在此5s内C的平均反应速率为0.2mol/(L•s),同时生成1mol D,v(D)=$\frac{\frac{1mol}{2L}}{5s}$=0.1mol/(L•s),由反应速率之比等于化学计量数之比可知x=4,则
3A(g)+B(g)???4C(g)+2D(g)
开始 2.5 2.5 0 0
转化 1.5 0.5 2 1
平衡 1 2 2 1
(1)达平衡时A的浓度是$\frac{1mol}{2L}$=0.5mol/L,故答案为:0.5mol/L;
(2)达平衡时B的转化率是$\frac{0.5}{2.5}$×100%=20%,故答案为:20%;
(3)由上述分析可知x的值是4,故答案为:4;
(4)若温度不变,达平衡时容器内气体的压强是反应前的$\frac{1+2+2+1}{2.5+2.5}$=1.2倍,故答案为:1.2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率的计算等为解答的关键,侧重分析与计算能力的考查,注意物质的量与压强的关系,题目难度不大.

| A. | Q2<Q1<92.4 | B. | 2Q2=Q1=92.4 | C. | Q1<Q2<92.4 | D. | Q2=Q1<92.4 |
| A. | 称量时,左盘低,右盘高 | B. | 定容时俯视读取刻度 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 定容时液面超过了刻度线 |
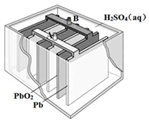 铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:
铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$ 2PbSO4(s)+2H2O(l)下列说法不正确的是( )
| A. | 放电时,电解质溶液的PH值增大 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g | |
| C. | 放电时,溶液中H+向PbO2电极移动 | |
| D. | 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l) |
| A. | 4 s(秒)时B的浓度为0.3 mol•L-1 | |
| B. | 4s内用物质A表示的反应速率为0.075 mol•L-1•s-1 | |
| C. | 达平衡后B的转化率为30% | |
| D. | 达平衡后若通入一定量氦气,A的转化率降低 |
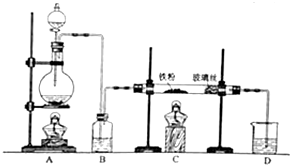 回答下列问题:
回答下列问题: