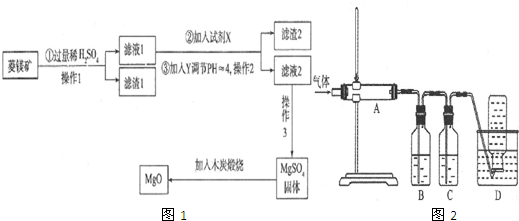
题目内容
11.由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝.工艺流程如下:(注:NaCl熔点为801℃;AlCl3在181℃时升华)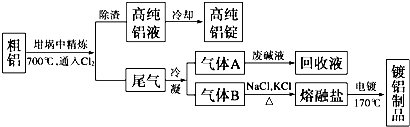
(1)精炼前,需消除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质.相关的化学方程式为①Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe和②3SiO2+4Al$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Si;
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去.气泡的主要成分除Cl2外还含有HCl、AlCl3;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在NaCl;
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;H++OH-═H2O;
(4)镀铝电解池中,金属铝为阳极.熔融盐电镀液中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电极的主要电极反应式为Al+7AlCl4--3e-═4Al2Cl7-.
分析 粗铝中含有Al、Na和氢气,在坩埚中精炼粗铝并加热至700℃,通入氯气,氯气和氢气反应生成HCl,Na、Al和氯气分别生成NaCl和AlCl3,所以得到的铝液为高纯铝液,然后冷却得到高纯铝锭;
NaCl熔点为801℃、AlCl3在181℃时升华,所以得到的尾气中含有HCl、Cl2和AlCl3,冷凝气体,气体A能和碱液反应,为HCl和Cl2,发生反应Cl2+2OH-═Cl-+ClO-+H2O、H++OH-═H2O;
气体B中含有AlCl3,将AlCl3和KCl、NaCl熔融,采用电镀方法得到镀铝制品,
(1)①高温下,氧化铁和铝发生铝热反应;
②高温下,铝和SiO2发生置换反应;
(2)气泡的主要成分除Cl2外还含有HCl、AlCl3;氯化钠熔点较高,在熔体表面形成浮渣;
(3)氯气和HCl都能和碱反应生成盐;
(4)电镀时阳极材料是镀层,铝电极上铝失电子和AlCl4-反应生成Al2Cl7-.
解答 解:粗铝中含有Al、Na和氢气,在坩埚中精炼粗铝并加热至700℃,通入氯气,氯气和氢气反应生成HCl,Na、Al和氯气分别生成NaCl和AlCl3,所以得到的铝液为高纯铝液,然后冷却得到高纯铝锭;
NaCl熔点为801℃、AlCl3在181℃时升华,所以得到的尾气中含有HCl、Cl2和AlCl3,冷凝气体,气体A能和碱液反应,为HCl和Cl2,发生反应Cl2+2OH-═Cl-+ClO-+H2O、H++OH-═H2O;
气体B中含有AlCl3,将AlCl3和KCl、NaCl熔融,采用电镀方法得到镀铝制品;
(1)高温下,氧化铁和铝发生铝热反应生成氧化铝和铁,反应方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,高温下,铝和SiO2发生置换反应生成氧化铝和Si,反应方程式为3SiO2+4Al$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Si,故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;3SiO2+4Al$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Si;
(2)NaCl熔点为801℃、AlCl3在181℃时升华,加热时氯化铝升华,所以得到的尾气中含有HCl、Cl2和AlCl3;氯化钠熔点较高,在熔体表面形成浮渣,
故答案为:HCl、AlCl3;NaCl;
(3)氯气和HCl都能和碱反应生成盐,离子反应方程式为Cl2+2OH-═Cl-+ClO-+H2O、H++OH-═H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;H++OH-═H2O;
(4)电镀时阳极材料是镀层,所以Al为阳极;铝电极上铝失电子和AlCl4-反应生成Al2Cl7-,电极反应式为Al+7AlCl4--3e-═4Al2Cl7-,
故答案为:阳;Al+7AlCl4--3e-═4Al2Cl7-.
点评 本题考查物质分离和提纯,为高频考点,涉及电解原理、离子反应、铝热反应等知识点,明确物质的性质是解本题关键,知道流程图中物质成分及其性质、发生的反应,难点是(4)题电极反应式的书写.

| A. | 加热才能发生的反应一定是吸热反应 | |
| B. | 断开化学键的过程会吸收能量 | |
| C. | 化学能不仅可以与热能相互转化,还可以与电能相互转化 | |
| D. | 燃烧可能为吸热反应 |
 铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种.
Ⅱ.所得气体B的可能组成是SO2、H2中的一种或两种.
【实验探究】
实验室提供下列试剂:0.01mol/L酸性KMnO4溶液、0.1mol/L KSCN溶液、3%H2O2溶液、淀粉溶液、蒸馏水.在配制0.01mol/L酸性KMnO4溶液溶液过程中,需要用到的玻璃仪器是烧杯、玻璃棒、100ml容量瓶和胶头滴管(填仪器名称).
请你完成以下探究实验.
| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | ①取适量A溶液,滴加0.1mol/LKSCN溶液 ②另取适量A溶液,滴加少量0.01mol/L酸性KMnO4溶液 | ①酸性高锰酸钾溶液褪色,说明含有亚铁离子; ②溶液变为血红色 | 含有Fe2+和Fe3+ |
| 验证猜想Ⅱ | 将所得气体通入下图所示装置 | 甲中紫色褪去,乙中不褪色,试管中收集到气体 | 含有两种气体 |
| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 相对分子质量相等的两种物质,不一定是同分异构体 | |
| D. | 在常温常压下,C4H10是气体 |
| A. | 质谱 | B. | 红外光谱 | C. | 紫外光谱 | D. | 核磁共振谱 |
| A. | 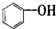 属于醇类化合物 属于醇类化合物 | B. | 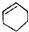 属于芳香族化合物 属于芳香族化合物 | ||
| C. | CH3CH(CH3)2属于链状化合物 | D. |  属于脂环化合物 属于脂环化合物 |
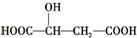 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |