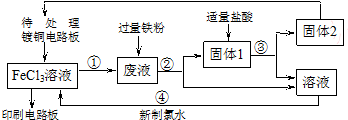
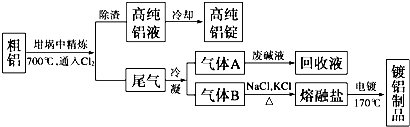
题目内容
2. 铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种.
Ⅱ.所得气体B的可能组成是SO2、H2中的一种或两种.
【实验探究】
实验室提供下列试剂:0.01mol/L酸性KMnO4溶液、0.1mol/L KSCN溶液、3%H2O2溶液、淀粉溶液、蒸馏水.在配制0.01mol/L酸性KMnO4溶液溶液过程中,需要用到的玻璃仪器是烧杯、玻璃棒、100ml容量瓶和胶头滴管(填仪器名称).
请你完成以下探究实验.
| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | ①取适量A溶液,滴加0.1mol/LKSCN溶液 ②另取适量A溶液,滴加少量0.01mol/L酸性KMnO4溶液 | ①酸性高锰酸钾溶液褪色,说明含有亚铁离子; ②溶液变为血红色 | 含有Fe2+和Fe3+ |
| 验证猜想Ⅱ | 将所得气体通入下图所示装置 | 甲中紫色褪去,乙中不褪色,试管中收集到气体 | 含有两种气体 |
分析 【提出猜想】铁和浓硫酸反应生成二氧化硫或氢气或二者都有;
【实验探究】根据仪器作用选取仪器,注意填的是玻璃仪器;
验证猜想I:亚铁离子能使酸性高锰酸钾溶液褪色,铁离子能使KSCN溶液变红色;
验证猜想II:二氧化硫能使酸性高锰酸钾溶液褪色,氢气不溶于水,利用排水法能收集到氢气;
【问题讨论】装置乙的作用是证明二氧化硫已经除尽,二氧化硫能够使品红溶液褪色,故也可使用品红溶液.
解答 解:【提出猜想】浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,所以所得气体中可能含有SO2、H2,
故答案为:SO2、H2中的一种或两种;
【实验探究】配制过程中,用托盘天平称量高锰酸钾、用胶头滴管定容,所以还需要的玻璃仪器为胶头滴管;
验证猜想I:亚铁离子能使酸性高锰酸钾溶液褪色,铁离子能使KSCN溶液变红色,其检验方法为:取少量液体倒入试管中,向试管中滴加KSCN溶液后,溶液变为血红色,说明含有铁离子,向溶液中滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,说明含有亚铁离子,如果两种现象都有,则说明含有铁离子和亚铁离子;
验证猜想II:二氧化硫有还原性,能和强氧化性的物质发生氧化还原反应,如能使酸性高锰酸钾溶液褪色,氢气不能使酸性高锰酸钾溶液褪色,但氢气不易溶于水,所以如果甲中KMnO4溶液褪色,说明含有二氧化硫;乙中KMnO4溶液颜色不变,说明二氧化硫完全被吸收,如果试管中收集气体,只能是氢气,
故答案为:胶头滴管;
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | ①取适量A溶液,滴加0.1 mol/L KSCN溶液 ②另取适量A溶液,滴加少量0.01 mol/L酸性KMnO4溶液 | ①酸性高锰酸钾溶液褪色,说明含有亚铁离子;②溶液变为血红色 | |
| 验证猜想Ⅱ | 甲中紫色褪去,乙中不褪色,试管中收集到气体 |
【问题讨论】装置甲用于除去二氧化硫,然后用装置乙检验二氧化硫已经除尽,根据二氧化硫具有漂白性,能够使品红溶液褪色可知,装置乙换成品红溶液,同样达到实验目的,
故答案为:品红溶液.
点评 本题考查了浓硫酸的性质、性质实验方案设计,题目难度中等,明确物质的性质为解答关键,根据物质的性质确定可能发生的反应及反应现象,注意掌握亚铁离子及铁离子的检验方法、性质实验方案的设计原则.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
10.下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是( )
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Na2S与FeCl3溶液.
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Na2S与FeCl3溶液.
| A. | 除③外 | B. | 除①④⑥外 | C. | 除②③⑤外 | D. | 除②⑤外 |
11.在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)?2C(g)+D(S),可以判断达到化学平衡状态的是( )
| A. | 体系压强不变 | |
| B. | 单位时间消耗n molA,同时生成2nmolC | |
| C. | 容器内气体密度不变 | |
| D. | A、B、C、D的反应速率之比为1:1:2:1 |
8.已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O把下列四种Na2S2O3溶液分别加入四个盛有10mL 2mol/L硫酸的锥形瓶中,并加水稀释到50mL,其中出现浑浊最快的是( )
| A. | 20℃,20mL、3mol/L的Na2S2O3溶液 | B. | 10℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 10℃,30mL、2mol/L的Na2S2O3溶液 | D. | 20℃,10mL、4mol/L的Na2S2O3溶液 |
15. 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
12.区别CH3CH2CH2OH与 的方法是( )
的方法是( )
 的方法是( )
的方法是( )| A. | 加入金属钠 | |
| B. | 加银氨溶液 | |
| C. | 在铜存在下和氧气反应 | |
| D. | 在铜存在下和氧气反应后的产物中加入银氨溶液共热 |