题目内容
3.13.0g锌与一定量的含HCl 36.5%稀盐酸恰好完全反应,则:(1)最多可收集到多少摩尔氢气?
(2)消耗的稀盐酸溶液的质量是多少?
分析 发生Zn+2HCl=ZnCl2+H2↑,n(Zn)=$\frac{13.0g}{65g/mol}$=0.2mol,结合反应及溶液质量分数=$\frac{溶质质量}{溶液质量}$计算.
解答 解:(1)n(Zn)=$\frac{13.0g}{65g/mol}$=0.2mol,由Zn+2HCl=ZnCl2+H2↑可知,n(H2)=n(Zn)=0.2mol,
答:最多可收集到0.2摩尔氢气;
(2)由Zn+2HCl=ZnCl2+H2↑可知,n(HCl)=0.2mol×2=0.4mol,m(HCl)=0.4mol×36.5g/mol=14.6g,消耗的稀盐酸溶液的质量是$\frac{14.6g}{36.5%}$=40g,
答:消耗的稀盐酸溶液的质量是40g.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.以下转化能通过一步反应实现的是( )
| A. | Al2O3→Al(OH)3 | B. | Al→Na[Al (OH)4] | C. | Fe→Fe(OH)2 | D. | SiO2→H2SiO3 |
14.2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走.下列说法不正确的是( )
| A. | 在生活舱中,可用过氧化钠制备氧气 | |
| B. | 金属镁可用作制造飞机、火箭的重要材料 | |
| C. | 在航天试验用的仪器仪表中大量使用了硅等非金属材料 | |
| D. | 返回舱外层的隔热瓦使用的是金属材料 |
18.下列实验方案中,可达到预期目的是( )
| A. | 用萃取的方法分离Br2和CCl4混合物 | |
| B. | 加足量烧碱溶液过滤.除去混在镁粉中的少量铝粉 | |
| C. | 加人盐酸酸化的Ba(NO3)2溶液,可以鉴别Na2SO3和Na2SO4 | |
| D. | 用溶解、过滤的方法分离KNO3和NaCl的混合物 |
8.0.5L1mol•L-1FeCl3溶液与0.2L1mol•L-1KCl溶液中的Cl-的数目之比为( )
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
15.下列说法不正确的是( )
| A. | 用玻璃棒蘸取0.01mol•L-1氢氧化钠溶液,点在广范pH试纸中部,与标准比色卡对照,测得其pH为12 | |
| B. | 向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察到蓝色晶体变成白色粉末 | |
| C. | 在2只相同小烧杯中分别加入50mL物质的量浓度均为0.1mol•L-1的硫酸、醋酸溶液,进行导电性实验,接通电源,观察到硫酸的小灯泡比醋酸的小灯泡明亮,可得到的结论是,硫酸是强电解质,醋酸是弱电解质 | |
| D. | 在洁净的试管中加入2mL新制氯水,再向试管中加入几滴硝酸银和稀硝酸,产生白色沉淀,则证明新制氯水中含有Cl- |
14.有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用,如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物.下列说法中正确的是( )
| A. | 34S原子核内的中子数为16 | B. | 13C和15N原子核内的质子数相差1 | ||
| C. | 13C18O的摩尔质量为31 | D. | 2H+的酸性比1H+的酸性更强 |

 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CO2↑
+CO2↑ $→_{△}^{NaOHaq}$
$→_{△}^{NaOHaq}$ +H2O
+H2O .
.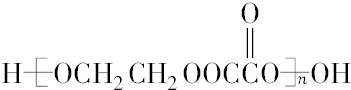 .
.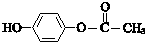 .
. 可以被酸性KMnO4溶液氧化,生成
可以被酸性KMnO4溶液氧化,生成 ,但若烷基R中直接与苯环相连的碳原子上没有C-H键,则不容易被氧化到
,但若烷基R中直接与苯环相连的碳原子上没有C-H键,则不容易被氧化到 .现有分子式为C11H16的一烷基取代苯,已知它可以被氧化成为
.现有分子式为C11H16的一烷基取代苯,已知它可以被氧化成为 的异构体共有7种,其中3种是
的异构体共有7种,其中3种是 ,请写出其他4种的结构简式:
,请写出其他4种的结构简式: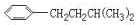 、
、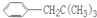 、
、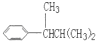 、
、 .
.