题目内容
9.下列物质中既能与稀硫酸反应,又能与NaOH溶液反应的是( )①NaHCO3 ②Al(OH)3 ③NH4HSO3 ④Al2O3 ⑤Al.
| A. | ②④⑤ | B. | ①②④⑤ | C. | ②③④⑤ | D. | 全部 |
分析 既能与NaOH溶液反应,又能与稀硫酸反应的物质有:铝、两性氧化物、两性氢氧化物、弱酸酸式盐、弱酸的铵盐、蛋白质、氨基酸等,据此解答.
解答 解:①NaHCO3 为弱酸的酸式盐,与氢氧化钠反应生成碳酸钠和水,与硫酸反应生成硫酸钠和二氧化碳和水,故选;
②Al(OH)3 为两性氢氧化物,与硫酸、氢氧化钠反应都生成盐和水,故选;
③NH4HSO3 为弱酸的铵盐,与氢氧化钠反应生成亚硫酸钠和一水合氨,与硫酸反应生成硫酸铵和亚硫酸,故选;
④Al2O3 为两性氧化物,与硫酸、氢氧化钠反应都生成盐和水,故选;
⑤Al与硫酸反应生成硫酸铝和氢气,与氢氧化钠反应生成偏铝酸钠和氢气,故选;
故选:D.
点评 本题考查了物质的性质,难度不大,明确物质的性质是解本题的关键,注意归纳总结既能与酸又能与碱反应的物质.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
19.相同温度下等物质的量浓度的下列溶液中,pH值最大的是 ( )
| A. | NH4Cl | B. | NH3.H2O | C. | NH4HSO4 | D. | (NH4)2SO4 |
14.下列离子方程式的书写正确的是( )
| A. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| C. | 氨水与FeCl3溶液反应:3OH-+Fe3+═Fe(OH)3↓ | |
| D. | NaOH与盐酸反应:OH-+H+═H2O |
1.下列有关概念间关系的说法正确的是( )
| A. | 失电子越多,还原性就一定越强 | |
| B. | 某元素由单质变为化合物,该元素有可能被氧化也有可能被还原 | |
| C. | 某物质焰色反应呈黄色,该物质一定含钠单质,可能含钾单质 | |
| D. | 金属氧化物一定是碱性氧化物 |
18.把一块镁铝合金投入到一定体积1mol/L 盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图A所示.下列说法中不正确的是( )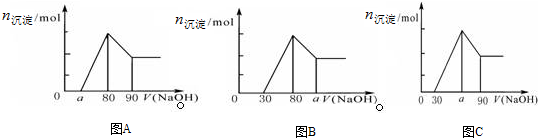

| A. | A图中a的取值范围为 0≤a<50 | |
| B. | A图中$\frac{n(Mg)}{n(Al)}$的最大值为2.5 | |
| C. | 若将关系图改为B图时,则a的取值范围为80<a<90 | |
| D. | 若将关系图改为C图时,则a的取值范围为75<a<90 |
19.下列各组溶液中的离子,因发生氧化还原反应而不能大量共存在溶液中的是( )
| A. | H+、Ca2+、NO3-、CO32- | B. | K+、H+、Fe2+、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | NH4+、K+、OH-、SO42- |
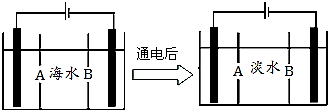 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.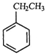 (g)+CO2(g)?
(g)+CO2(g)?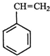 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)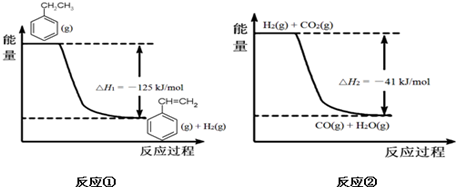
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ ,该聚合物的链节为
,该聚合物的链节为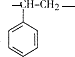 .
. X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.