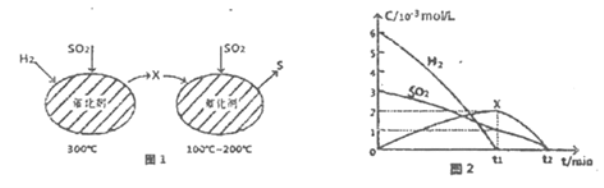
题目内容
【题目】通过简单的计算完成下列问题:
(1)已知:常温下HF的Ka=1×10-4,NH3H2O的Kb=1×10-5,则NH4F溶液显_______性,保存此溶液应该放在_______中。
(2)已知:常温下 H2S的Ka1=1×10-7、Ka2=1×10-15,CuS的Ksp=1×10-36,FeS的Ksp=1×10-17,则:
①反应CuS(s)+2HCl(aq)![]() H2S(aq)+CuCl2(aq)的K=__________;反应FeS(s)+2HCl(aq)
H2S(aq)+CuCl2(aq)的K=__________;反应FeS(s)+2HCl(aq)![]() H2S(aq)+FeCl2(aq)的 K=_____;
H2S(aq)+FeCl2(aq)的 K=_____;
由计算结果我们可以知道CuS和FeS中________可溶于盐酸。
②反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的K=_____;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. _________________________________。
FeS(s)+Cu2+(aq)的K=_____;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. _________________________________。
(3)已知:常温下 Fe(OH)3的 Ksp=1×10-38,则 Fe3+沉淀完全的pH=______;配置FeCl3溶液的方法是______。(以浓度≤10-5mol/L为沉淀完全)
【答案】 酸 塑料瓶 10-14 105 FeS 10-19 进入废水中的Fe2+被空气中 的O2氧化,生成的Fe3+水解产生Fe(OH)3 胶体,吸附杂质使杂质沉降 3 将FeCl3固体溶于较浓的 HCl 中,再加水稀释至所需浓度
【解析】(1)已知:常温下HF的Ka=1×10-4,NH3H2O的Kb=1×10-5,则铵根离子的水解程度大于氟离子的水解,则NH4F溶液显酸性,水解产生氢氟酸,故保存此溶液应该放在塑料瓶中;(2)①反应CuS(s)+2HCl(aq)![]() H2S(aq)+CuCl2(aq)的
H2S(aq)+CuCl2(aq)的 ,反应FeS(s)+2HCl(aq)
,反应FeS(s)+2HCl(aq)![]() H2S(aq)+FeCl2(aq)的
H2S(aq)+FeCl2(aq)的 ![]() ;②反应 CuS(s)+Fe2+(aq)
;②反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的
FeS(s)+Cu2+(aq)的 ;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. 进入废水中的Fe2+被空气中 的O2氧化,生成的Fe3+水解产生Fe(OH)3 胶体,吸附杂质使杂质沉降;(3)已知:Fe3+沉淀完全的浓度为
;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. 进入废水中的Fe2+被空气中 的O2氧化,生成的Fe3+水解产生Fe(OH)3 胶体,吸附杂质使杂质沉降;(3)已知:Fe3+沉淀完全的浓度为![]() ,常温下 Fe(OH)3的 Ksp=c(Fe3+)c3(OH-)=
,常温下 Fe(OH)3的 Ksp=c(Fe3+)c3(OH-)= ![]() ×c3(OH-)=1×10-38,则 c(OH-)=1×10-11,Fe3+沉淀完全的pH=3;为防止FeCl3水解,配置FeCl3溶液的方法是将FeCl3固体溶于较浓的 HCl 中,再加水稀释至所需浓度。
×c3(OH-)=1×10-38,则 c(OH-)=1×10-11,Fe3+沉淀完全的pH=3;为防止FeCl3水解,配置FeCl3溶液的方法是将FeCl3固体溶于较浓的 HCl 中,再加水稀释至所需浓度。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) ![]() CH3COOH(g)△H<0。下列说法正确的是
CH3COOH(g)△H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1
【题目】利用下图装置可以进行实验并能达到实验目的的是
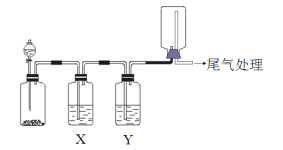
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 用CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4溶液 |
A. A B. B C. C D. D