题目内容
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、气态氢化物的稳定性:HnX 强于HmY |
| B、X和Y形成化合物时,X显负价,Y显正价 |
| C、第一电离能一定是:Y小于X |
| D、最高价含氧酸的酸性:X>Y |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.非金属性越强,气态氢化物越稳定;
B.电负性大的元素在化合物中显负价;
C.一般非金属性强的,其第一电离能大;
D.非金属性越强,其最高价氧化物的水化物的酸性越强,但O、F除外.
A.非金属性越强,气态氢化物越稳定;
B.电负性大的元素在化合物中显负价;
C.一般非金属性强的,其第一电离能大;
D.非金属性越强,其最高价氧化物的水化物的酸性越强,但O、F除外.
解答:
解:X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY小于HnX,故A正确;
B.电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故B正确;
C.一般非金属性强的第一电离能大,但特殊O的非金属性比N大,但第一电离能N>O,故C错误;
D.非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性X>Y,则X对应的最高价含氧酸的酸性强于Y对应的最高价含氧酸的酸性,故D正确.
故选C.
A.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY小于HnX,故A正确;
B.电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故B正确;
C.一般非金属性强的第一电离能大,但特殊O的非金属性比N大,但第一电离能N>O,故C错误;
D.非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性X>Y,则X对应的最高价含氧酸的酸性强于Y对应的最高价含氧酸的酸性,故D正确.
故选C.
点评:本题考查位置、结构、性质,明确同周期位置关系及电负性大小得出元素的非金属性是解答本题的关键,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物.下列物质不属于氢化物的是( )
| A、H2O |
| B、H2SO4 |
| C、NaH |
| D、NH3 |

 实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:
实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:
 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.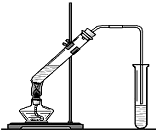 (1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
(1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止