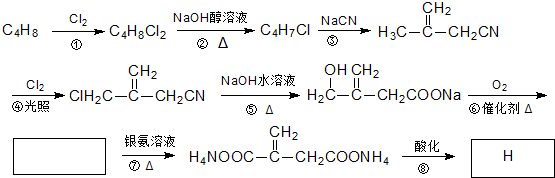
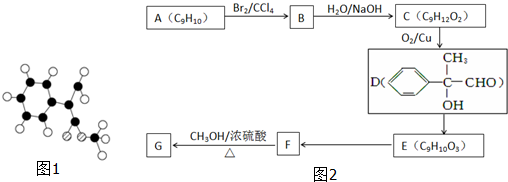
题目内容
下列说法正确的是(NA为阿伏伽德罗常数)( )
| A、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| B、1摩尔CnH2n+2中含有共价键个数为(3n+2)NA |
| C、准状况下,22.4LCO2和O2混合气体中含有的氧原于数约为2NA |
| D、1L1mol/L的K2CO3溶液中离子总数小于3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、常温常压下Vm≠22.4L/mol;
B、烷烃中碳碳间共用电子对数为碳原子数减去1;碳氢电子对数与H原子个数相同,据此计算即可;
C、标准状况下,22.4LCO2和O2混合气体的物质的量为1mol,然后根据CO2和O2均含2个氧原子来分析;
D、碳酸根离子部分水解,导致溶液中阴离子的数目增多;
B、烷烃中碳碳间共用电子对数为碳原子数减去1;碳氢电子对数与H原子个数相同,据此计算即可;
C、标准状况下,22.4LCO2和O2混合气体的物质的量为1mol,然后根据CO2和O2均含2个氧原子来分析;
D、碳酸根离子部分水解,导致溶液中阴离子的数目增多;
解答:
解:A、常温常压下Vm≠22.4L/mol(大于22.4),氯气不足,转移的电子数小于3nA,故A错误;
B、分子式为CnH2n+2的烃分子中,碳原子数为n,则烷烃中碳碳间共用电子对数为n-1,C-H的对数为2n+2,故1molCnH2n+2的总电子对数为:n-1+2n+2=3n+1,故B错误;
C、标准状况下,22.4LCO2和O2混合气体的物质的量为1mol,而CO2和O2均含2个氧原子,故1molCO2和O2混合气体中含2mol氧原子,故C正确;
D、1L 1mol/L的K2CO3溶液中含有溶质碳酸钾1mol,由于碳酸根离子水解使溶液中阴离子数目增多,所以溶液中阴离子大于1mol,离子总物质的量大于3mol,离子总数大于3NA,故D错误;
故选C.
B、分子式为CnH2n+2的烃分子中,碳原子数为n,则烷烃中碳碳间共用电子对数为n-1,C-H的对数为2n+2,故1molCnH2n+2的总电子对数为:n-1+2n+2=3n+1,故B错误;
C、标准状况下,22.4LCO2和O2混合气体的物质的量为1mol,而CO2和O2均含2个氧原子,故1molCO2和O2混合气体中含2mol氧原子,故C正确;
D、1L 1mol/L的K2CO3溶液中含有溶质碳酸钾1mol,由于碳酸根离子水解使溶液中阴离子数目增多,所以溶液中阴离子大于1mol,离子总物质的量大于3mol,离子总数大于3NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
在523K时,有以下反应:2HCl(g)+CrO3(g)═CrO2Cl2(g)+H2O(g)+Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是( )
| A、加热 | B、使用催化剂 |
| C、加压 | D、分离出水气 |
基因测序研究中,常用
P作标记物,下列关于
P的说法正确的是( )
32 15 |
32 15 |
| A、质子数为32 |
| B、质量数为15 |
| C、32P与33P互为同位素 |
| D、中子数为15 |
下列属于放热反应的是( )
| A、生石灰和水 |
| B、碳酸钙高温分解 |
| C、灼热的碳和二氧化碳 |
| D、Ba(OH)2?8H2O晶体和NH4Cl |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA |
| B、标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA |
| C、8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA |
| D、1 mol Na被完全氧化生成Na2O2,失去2 NA个电子 |
下列物质中属于电解质的是( )
| A、Cu |
| B、蔗糖 |
| C、Na2CO3 |
| D、乙醇 |