题目内容
1.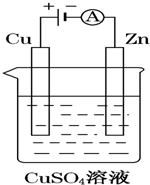 如图是一个电解过程示意图.
如图是一个电解过程示意图.①锌片上发生的电极反应式是:Cu2++2e-=Cu
②假设使用肼-空气燃料电池作为该过程中的电源,锌片质量变化为64g,则肼-空气燃料电池理论上消耗标准状况下的空气56L(假设空气中氧气体积分数为20%).
分析 ①电解池的阴极上是阳离子发生得电子的还原反应;
②根据电极反应,结合电子守恒和空气的组成情况来回答;
解答 解:①与电源负极相连的Zn是电解池的阴极,在锌片上阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②锌片上发生的电极反应式是Cu2++2e-=Cu,锌片质量变化为64g,即析出64gCu,根据电极反应,转移电子为$\frac{64g}{64g/mol}$×2=2mol,根据反应N2H4+O2=N2+2H2O,当转移电子2mol时,消耗氧气的物质的量是0.5mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是2.5mol,即标准状况下2.5mol×22.4L/mol=56L,
故答案为:56.
点评 本题考查了电解池原理及物质的量的计算,根据各个电极上得失电子书写电极反应,再结合电极反应式进行有关计算,题目难度中等.

练习册系列答案
相关题目
12.短周期非金属元素X和Y能形成XY2型化合物,下列有关说法正确的是( )
| A. | XY2一定能与水反应 | B. | X可能是ⅣA、VA或ⅥA族元素 | ||
| C. | 符合要求的XY2物质有两种 | D. | X、Y一定不是同一主族的元素 |
6.下列叙述正确的是( )
| A. | 物质燃烧都是放热反应 | |
| B. | 化学反应总是伴随着能量的变化 | |
| C. | 化学反应中需要加热的反应一定是吸收反应 | |
| D. | 化学反应中放出的热量就是反应热 |
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 中性溶液:Fe3+、K+、Cl-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42- | |
| D. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- |
11.化学反应2AB=A2+B2的能最变化如图所示,下列说法正确的是( )
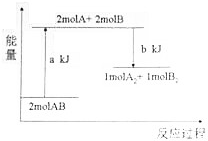

| A. | 该反应是放热反应 | |
| B. | 该反应一定要在加热条件下才能进行 | |
| C. | 断开lmolA2中的化学键和lmolB2中的化学键需吸收akJ的能量 | |
| D. | 1moIA2和1moIB2的总能量高于2molAB的总能量 |
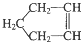 可简写为
可简写为 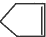 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: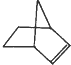
 .
.