题目内容
4.(1)25℃纯水中的[H+]=2.0×10-7mol/L,则此溶液中的[OH-]=2.0×10-7mol/L.(2)常温下将0.1mol•L-1氢氧化钠溶液与0.06mol•L-1硫酸溶液等体积混合,该混合溶液的pH等于2;
(3)实验室为了配制FeSO4溶液往往(1)要加入少量稀H2SO4,其目的是抑制Fe2+水解.
分析 (1)纯水显中性,故c(H+)=c(OH-);
(2)常温下,将0.1mol•L-1氢氧化钠溶液与0.06mol•L-1硫酸溶液等体积混合,先判断过量,然后计算过量的酸或碱的物质的量浓度,最后计算溶液的pH;
(3)Fe2+离子在水溶液中水解.
解答 解:(1)纯水呈中性,则纯水中c(H+)=c(OH-)=2.0×10-7 mol/L,故答案为:2.0×10-7;
(2)常温下氢氧化钠溶液物质的量浓度为0.1mol/L,设溶液的体积都是1L,则氢氧化钠的物质的量为:1L×0.1mol•L-1=0.1mol,
硫酸的物质的量为:1L×0.06mol•L-1=0.06mol,含有H+的物质的量为0.06mol×2=0.12mol,
酸碱发生中和时H+和OH-的物质的量分别为0.12mol和0.1mol,则硫酸过量,过量的H+的物质的量为:0.12mol-0.1mol=0.02mol,
反应后溶液中H+的物质的量浓度为:c(H+)=$\frac{0.02mol}{2L}$=0.01 mol•L-1,
该混合液的pH=-lg10-2=2.0,故答案为:2;
(3)Fe2+离子在水溶液中水解使配制的溶液变浑浊,加入少量H2SO4 可以抑制二价铁离子的水解,故答案为:抑制Fe2+水解.
点评 本题主要考查溶液pH的有关计算和盐类水解的应用,题目难度中等,明确酸碱反应的过量分析是解答的关键,并应熟悉物质的量的计算、pH的计算公式来解答即可,试题培养了学生的化学计算能力.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
14.下列元素中,金属活泼性最强的是( )
| A. | Na | B. | Mg | C. | Al | D. | Li |
12.下列离子方程式正确的是( )
| A. | 铁和稀HNO3反应后的溶液pH=1:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氢镁溶液中加入过量澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| C. | 0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
19.下列化学方程式中,属于水解反应的是( )
| A. | H2O+H2O?H3O++OH- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?H2CO3 | D. | HCO3-+H2O?CO32-+H3+O |
9.下列叙述正确的是( )
| A. | 除去CO2气体中的少量HCl:通入Na2CO3溶液洗气 | |
| B. | CH3COONa、BaSO4、NaOH都是强电解质 | |
| C. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| D. | 浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳 |
16.如表是元素周期表的一部分,回答下列问题
(1)表中元素②最简单氢化物的电子式为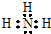 ,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
(2)工业生产单质④的原理是2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑(用化学方程式表示).
(3)已知某些不同族元素的性质也有一定的相似性,如元素①与元素④的氢氧化物有相似的性质.写出元素①的氢氧化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH=Na2BeO2+2H2O.
(4)0.2mol的单质⑥与100ml2mol•L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是1:1.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ||||
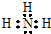 ,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.(2)工业生产单质④的原理是2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑(用化学方程式表示).
(3)已知某些不同族元素的性质也有一定的相似性,如元素①与元素④的氢氧化物有相似的性质.写出元素①的氢氧化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH=Na2BeO2+2H2O.
(4)0.2mol的单质⑥与100ml2mol•L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是1:1.
13.光导纤维的主要成分是SiO2,下列叙述正确的为( )
| A. | SiO2的摩尔质量为60 | |
| B. | 标况下,15gSiO2的体积为5.6L | |
| C. | SiO2 中Si 和 O的质量比为7:8 | |
| D. | 相同质量的SiO2 和CO2中所含O原子的数目相同 |
14.维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如下:
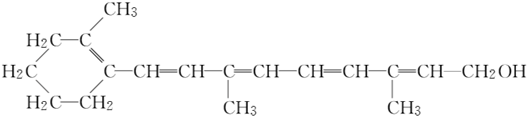
下列有关维生素A1的叙述错误的是( )

下列有关维生素A1的叙述错误的是( )
| A. | 维生素A1中含有两种官能团 | |
| B. | 维生素A1 的分子式为C18H26O | |
| C. | 维生素A1可使酸性高锰酸钾溶液褪色 | |
| D. | 维生素A1分子中含有苯环,1 mol维生素A1最多可与7 mol H2发生加成反应 |



