题目内容
18.常温常压下,等质量的氧气和臭氧(O3)原子数之比1:1,两气体的体积之比3:2.分析 根据V=n×Vm标准状况下气体的体积,然后求出两者之比;根据气体的物质的量以及分子的组成来确定原子的个数,由此分析解答.
解答 解:设质量都为mg,则有:n(O2)=$\frac{mg}{32g/mol}$,n(O3)=$\frac{mg}{48g/mol}$
它们的物质的量之比为3:2;
氧气的体积为$\frac{mg}{32g/mol}$×22.4L/mol,臭氧(O3)的体积为$\frac{mg}{48g/mol}$×22.4L/mol,
标准状况下两者的体积之比为3:2;
氧气中原子的个数为$\frac{mg}{48g/mol}$×2×NA,臭氧中原子的个数为$\frac{mg}{48g/mol}$×3×NA,
原子的个数之比为1:1,
故答案为:1:1;3:2.
点评 本题考查物质的量的相关计算,题目难度不大,注意相关计算公式的运用.

练习册系列答案
相关题目
8.用作调味品的食醋也可用来除水垢,其除垢的有效成分是( )
| A. | 乙醇 | B. | 乙酸 | C. | 葡萄糖 | D. | 乙酸乙酯 |
9.分子式为C7H11Cl的有机物,其结构不可能是( )
| A. | 含1个双键的环状有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 只含有1个双键的直链有机物 | D. | 含一个三键的直链有机物 |
6.下列试剂中需要张贴图标志的是( )


| A. | HNO3 | B. | CuO | C. | NaCl | D. | C2H5OH |
13.下列关于平衡常数K的说法中,错误的是( )
| A. | 升高温度,K值增大 | B. | K值越大,反应物转化率越大 | ||
| C. | 加入催化剂不改变平衡常数K | D. | 平衡向右移动K值不一定改变 |
7. 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.
(提示:滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O)
试回答下列问题:
(1)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色.
(2)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(3)用0.1mol/L KMnO4标准溶液滴定草酸溶液时,以下操作会使结果偏低的①④(填序号).
①实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
②酸式滴定管未用标准液润洗
③锥形瓶用待测液润洗
④滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为30.00mL,三次实验结果记录如表:
根据所给数据,计算H2C2O4的物质的量浓度C=0.211mol/L.(小数点后保留3位数字)
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.(提示:滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O)
试回答下列问题:
(1)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色.
(2)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(3)用0.1mol/L KMnO4标准溶液滴定草酸溶液时,以下操作会使结果偏低的①④(填序号).
①实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
②酸式滴定管未用标准液润洗
③锥形瓶用待测液润洗
④滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为30.00mL,三次实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 30.32 | 25.34 | 25.30 |
5.下列说法中正确的是( )
| A. | 明矾的化学式为Al2(SO4)3•12H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | AlCl3溶液与浓氨水反应有白色沉淀生成 | |
| D. | Al是重要的金属元素,其对应的氧化物为碱性氧化物 |
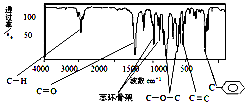
 (不考虑立体异构)
(不考虑立体异构)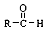 +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$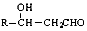 $\stackrel{-H_{2}O}{→}$RCH=CHCHO
$\stackrel{-H_{2}O}{→}$RCH=CHCHO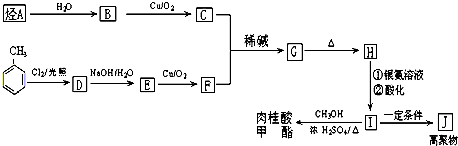

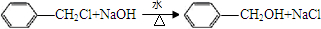
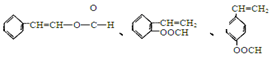
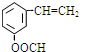 、
、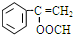 .
.