题目内容
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)?2SO3(g);
△H=-a kJ?mol-1在相同条件下,要想得到2akJ热量,加入各物质的物质的量可能是( )
△H=-a kJ?mol-1在相同条件下,要想得到2akJ热量,加入各物质的物质的量可能是( )
| A、4molSO2和2molO2 |
| B、5molSO2和3molO2 |
| C、4molSO2和4molO2 |
| D、2molSO2、1molO2和2molSO3 |
考点:化学反应的可逆性
专题:化学平衡专题
分析:由反应方程式可知生成2mol的SO3时放热a kJ,想得到2a kJ热量,则需生成4molSO3;由于反应是可逆反应,不可能完全进行到底,所以要得到4molSO3,SO2与O2物质的量必须要多于4mol和2mol.
解答:
解:由反应方程式可知生成2mol的SO3时放热a kJ,想得到2a kJ热量,则需生成4molSO3;由于反应是可逆反应,不可能完全进行到底,所以要得到4molSO3,SO2与O2物质的量必须要多于4mol和2mol,
故选B.
故选B.
点评:本题考查可逆反应的特点,难度不大.要注意可逆反应的特点:反应物不可能100%地全部转化为生成物.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
下列有关热化学方程式的叙述正确的是( )
| A、已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-893.0kJ/mol,则甲烷的燃烧热为893.0kJ?mol-1 | ||
| B、已知4P(红磷,s)═P4(白磷,s);△H>0,则白磷比红磷稳定 | ||
C、含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,反应的化学方程式为:NaOH(aq)+
| ||
D、己知C(s)+O2(g)═CO2(g);△H1C(s)+
|
下列反应中,最终一定有白色沉淀生成的是( )
①向Na2SO4溶液中加入稀盐酸酸化后,再加入BaCl2溶液;
②向Na2SiO3溶液中通入过量的CO2;
③向Ca(OH)2溶液中通入过量的CO2;
④向BaCl2溶液中通入少量的SO2;
⑤向Ba(NO3)2溶液中通入过量的SO2.
①向Na2SO4溶液中加入稀盐酸酸化后,再加入BaCl2溶液;
②向Na2SiO3溶液中通入过量的CO2;
③向Ca(OH)2溶液中通入过量的CO2;
④向BaCl2溶液中通入少量的SO2;
⑤向Ba(NO3)2溶液中通入过量的SO2.
| A、①② | B、①③④ |
| C、①②⑤ | D、②③④ |
下列有机物的命名正确的是( )
A、 2-乙基丙烷 2-乙基丙烷 |
| B、CH3-CH=CH-CH3 2-丁烯 |
C、 3,4─二甲基戊烷 3,4─二甲基戊烷 |
D、 二甲基苯 二甲基苯 |
盐类的水解过程中正确的说法是( )
| A、盐的电离平衡破坏 |
| B、水的电离平衡发生移动 |
| C、溶液的PH减小 |
| D、没有发生中和反应 |
对于达到平衡的可逆反应H2(g)+I2(g)?2HI(g) (正反应是放热反应),欲使混合气体的颜色变深,应采取的措施是( )
| A、升高温度 | B、降低温度 |
| C、增大压强 | D、减少压强 |
A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数不可能为( )
| A、a-4 | B、a-5 |
| C、a+3 | D、a+11 |
某些稠环环芳烃的结构简式如图: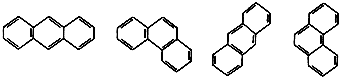 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、这些结构简式表示的化合物有3种 |
| B、它们的分子式不相同 |
| C、所有原子均在同一平面 |
| D、它们与苯互为同系物 |