题目内容
7.某反应的反应物与生成物有SeO2、HNO3、KI、Se、KNO3、H2O、I2,已知氧化性:SeO2>I2,则下列说法正确的是( )| A. | HNO3作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量之比为1:1 | |
| C. | 当生成1molI2时,转移2mol电子 | |
| D. | 由该反应可知还原性:Se>KI |
分析 某反应的反应物与生成物有SeO2、HNO3、KI、Se、HNO3、H2O、I2,已知氧化性:SeO2>I2,可知为SeO2、KI、HNO3、反应物,则KNO3、Se、I2、H2O为生成物,反应的方程式为SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O,反应中Se元素的化合价降低,被还原,I元素的化合价升高,被氧化,以此解答该题.
解答 解:某反应的反应物与生成物有SeO2、HNO3、KI、Se、HNO3、H2O、I2,已知氧化性:SeO2>I2,可知为SeO2、KI、HNO3、反应物,则KNO3、Se、I2、H2O为生成物,反应的方程式为SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O,反应中Se元素的化合价降低,被还原,I元素的化合价升高,被氧化,
A.反应前后N元素化合价没有变化,硝酸表现酸性,不是氧化剂,故A错误;
B.由方程式可知氧化剂和还原剂的物质的量之比为1:4,故B错误;
C.反应中I元素化合价由-1价升高到0价,则当生成1molI2时,转移2mol电子,故C正确;
D.由方程式可知KI为还原剂,Se为还原产物,则还原性KI大于Se,故D错误.
故选C.
点评 本题考查氧化还原,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意根据在同一反应中氧化剂氧化性大于氧化产物氧化性来判断氧化性的强弱.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 12C与14C互称同位素,O2与O3是氧元素的同素异形体 | |
| B. | SO2和SO3属于酸性氧化物,Na2O和Na2O2属于碱性氧化物 | |
| C. | 潮解和电解属于化学变化,蒸馏和干馏属于物理变化 | |
| D. | 沼气和水煤气属于可再生能源,锌锰干电池和铅蓄电池属于二次电池 |
2.在2KMnO4+16HCl=2MnCl2+5Cl2↑+8H2O+2KCl的反应中,氧化剂和还原剂物质的量之比是( )
| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
5.炼锌烟尘的主要成分为ZnO,含少量CuO和FeO,可以利用该烟尘制取Zn和ZnCl2.
Ⅰ.制取氯化锌的主要工艺如下:
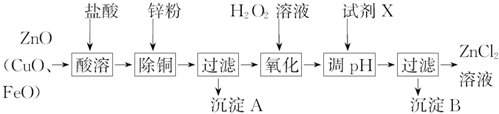
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)加入H2O2溶液的目的是将亚铁离子氧化为铁离子.
(2)流程图中,为了降低溶液的酸度,试剂X可以是abc(从下列四种物质中选择);pH应调整到3.2≤pH<5.2.
a.ZnO b.Zn(OH)2 c.Zn2(OH)2CO3 d.ZnSO4
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.
Ⅱ.制取金属锌采用碱溶解:ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq),然后电解浸取液.
(4)以石墨作电极电解时,阳极放电的离子为OH-;阴极的电极反应式为[Zn(OH)4]2-+2e-=Zn+4OH-.
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
Ⅰ.制取氯化锌的主要工艺如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 9.7 |
(2)流程图中,为了降低溶液的酸度,试剂X可以是abc(从下列四种物质中选择);pH应调整到3.2≤pH<5.2.
a.ZnO b.Zn(OH)2 c.Zn2(OH)2CO3 d.ZnSO4
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.Ⅱ.制取金属锌采用碱溶解:ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq),然后电解浸取液.
(4)以石墨作电极电解时,阳极放电的离子为OH-;阴极的电极反应式为[Zn(OH)4]2-+2e-=Zn+4OH-.
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
12.根据碘与氢气反应的热化学方程式,下列判断正确的是
(i) H2(g)+I2(g)?2HI(g);△H=-9.48kJ/mol (ii) H2(g)+I2(s)?2HI(g);△H=+26.48kJ( )
(i) H2(g)+I2(g)?2HI(g);△H=-9.48kJ/mol (ii) H2(g)+I2(s)?2HI(g);△H=+26.48kJ( )
| A. | 1 mol I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol I2(s)升华,吸热17.00 kJ | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
10.在化学能与电能的转化过程中,下列叙述正确的是( )
| A. | 电解池的阳极一定是与电源正极相连,只能选择金属铂或石墨作阳极 | |
| B. | 用惰性材料作电极的电解池装置中,阳离子在阳极放电,阴离子在阴极放电 | |
| C. | 电镀时,电镀糟里的阳极材料发生氧化反应 | |
| D. | 原电池的负极与电解池的阴极都发生氧化反应 |
 ④
④ 和
和 ⑤CH3CH2CH2CH3和
⑤CH3CH2CH2CH3和
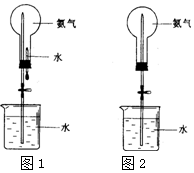 喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).
喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去). 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.