题目内容
12.实验室盛放NaOH溶液的试剂瓶应选用( )| A. | 细口橡胶塞试剂瓶 | B. | 细口玻璃塞试剂瓶 | ||
| C. | 广口橡胶塞试剂瓶 | D. | 广口玻璃塞试剂瓶 |
分析 玻璃中的二氧化硅与氢氧化钠反应生成具有粘性的硅酸钠溶液,能够将玻璃塞与玻璃瓶粘到一起,以此解答该题.
解答 解:玻璃中的二氧化硅与氢氧化钠反应生成具有粘性的硅酸钠溶液,能够将玻璃塞与玻璃瓶粘到一起,反应的方程式:SiO2+2NaOH=Na2SiO3+H2O,所以不能用带玻璃塞的试剂瓶盛放NaOH溶液,可放在细口橡胶塞试剂瓶.
故选A.
点评 本题考查元素化合物知识以及常见药品的保存,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.

练习册系列答案
相关题目
4.在两个恒容的密闭绝热容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)?CO(g)+H2(g);
乙:CO(g)+H2O(g)?CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变
③各气体组成浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
其中能表明甲、乙容器中反应都达到平衡状态的是( )
甲:C(s)+H2O(g)?CO(g)+H2(g);
乙:CO(g)+H2O(g)?CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变
③各气体组成浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
其中能表明甲、乙容器中反应都达到平衡状态的是( )
| A. | 仅④⑤ | B. | 仅③④⑥ | C. | 仅⑥⑦ | D. | 仅①②⑤ |
20.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0、△S<0 | |
| B. | 使用催化剂能够降低化学反应的反应热(△H) | |
| C. | 由Ka(HCN)<Ka(CH3COOH)可说明在相同条件下,氢氰酸的酸性比醋酸弱 | |
| D. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
7.下列关于1S电子在原子核外出现的概率分布图(电子云)的说法中,正确的是( )


| A. | 通常用小黑点来表示电子的多少 | |
| B. | 小黑点密表示在该核外空间的电子数多 | |
| C. | 小黑点密表示在该核外空间的单位体积内电子出现的概率大 | |
| D. | 通常用小黑点来表示电子绕核作高速圆周运动 |
17.下列化学反应属于取代反应的是( )
| A. | 乙炔与酸性高锰酸钾溶液的反应 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在镍作催化剂、加热的条件下苯与氢气的反应 | |
| D. | 在浓硫酸作用下,苯在55℃左右与浓硝酸的反应 |
4.下列对于废弃塑料制品的处理方法中,最为恰当的是( )
| A. | 将废弃物切成碎片,混在垃圾中填埋于土壤中 | |
| B. | 将废弃物焚烧 | |
| C. | 将废弃物加工成防水涂料或汽油,以节约资源 | |
| D. | 将废弃物倾倒在海洋中 |
1.已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )
| A. | 0.12 mol•L-1 | B. | 0.1 mol•L-1 | C. | 1.2 mol•L-1 | D. | 1.0 mol•L-1 |
2.25℃,将pH=6的CH3COOH溶液加水稀释1 000倍后,溶液中的( )
| A. | c(H+)≈10-9 mol/L | B. | pH=9 | C. | pH≈7 | D. | c(OH-)≈10-5mol/L |
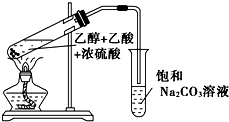 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.