题目内容
将24.4gNaOH固体溶于水,配成100mL溶液,其密度为1.22g/mL.
(1)该溶液中NaOH的物质的量浓度为 .
(2)该溶液中NaOH的质量分数为 .
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为 ,NaOH的质量分数为 ,溶液的密度为 ,含NaOH的质量为 ,含NaOH的物质的量为 .
(1)该溶液中NaOH的物质的量浓度为
(2)该溶液中NaOH的质量分数为
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为
考点:物质的量浓度的相关计算
专题:计算题
分析:根据n=
计算22.4gNaOH的物质的量,根据m=ρV计算溶液的质量,
(1)根据c=
计算;
(2)根据w=
×100%计算;
(3)溶液是均匀的,取出10mL溶液的物质的量浓度、质量分数、密度与原溶液相等;该10mL溶液中氢氧化钠的质量、物质的量为原溶液中的
.
| m |
| M |
(1)根据c=
| n |
| V |
(2)根据w=
| 溶质质量 |
| 溶液质量 |
(3)溶液是均匀的,取出10mL溶液的物质的量浓度、质量分数、密度与原溶液相等;该10mL溶液中氢氧化钠的质量、物质的量为原溶液中的
| 1 |
| 10 |
解答:
解:22.4gNaOH的物质的量为
=0.61mol,溶液质量为100mL×1.22g/mL=122g,
(1)该溶液中NaOH的物质的量浓度为
=6.1mol/L,
故答案为:6.1mol/L;
(2)该溶液中NaOH的质量分数为
×100%=20%,故答案为:20%;
(3)溶液是均匀的,取出10mL溶液的物质的量浓度、质量分数、密度与原溶液相等,故取出的10mL溶液的物质的量浓度、质量分数、密度分别为6.1mol/L、20%、1.22g/mL,
该10mL溶液中氢氧化钠的质量、物质的量为原溶液中的
,则10mL溶液中NaOH质量=24.4g×
=2.44g,氢氧化钠的物质的量=0.61mol×
=0.061mol,
故答案为:6.1mol/L;20%;1.22g/mL;2.44g;0.061mol.
| 24.4g |
| 40g/mol |
(1)该溶液中NaOH的物质的量浓度为
| 0.61mol |
| 0.1L |
故答案为:6.1mol/L;
(2)该溶液中NaOH的质量分数为
| 24.4g |
| 122g |
(3)溶液是均匀的,取出10mL溶液的物质的量浓度、质量分数、密度与原溶液相等,故取出的10mL溶液的物质的量浓度、质量分数、密度分别为6.1mol/L、20%、1.22g/mL,
该10mL溶液中氢氧化钠的质量、物质的量为原溶液中的
| 1 |
| 10 |
| 1 |
| 10 |
| 1 |
| 10 |
故答案为:6.1mol/L;20%;1.22g/mL;2.44g;0.061mol.
点评:本题考查物质的量浓度、质量分数的有关计算,比较基础,旨在考查学生对基础知识的理解掌握,注意对定义式的理解与灵活运用.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
已知下列几种烷烃的燃烧热数据如下:
据此判断,表示戊烷燃烧热的热化学方程式正确的是( )
| 烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 |
| 燃烧热(kJ?mol-1) | 890 | 1 560 | 2 220 | 2 880 |
| A、C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ?mol-1 |
| B、C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ?mol-1 |
| C、C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ?mol-1 |
| D、C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ?mol-1 |
下列离子在水溶液中能大量共存的一组是( )
| A、Ca2+、CO32-、SO42- |
| B、Fe2+、NO3-、H+ |
| C、NH4+、Cl-、HCO3- |
| D、K+、H+、OH- |
NA为阿伏加德罗常数.则下列说法正确的是( )
| A、标准状况下,2.24L Cl2与热碱溶液完全反应生成Cl-和ClO3-转移了0.1NA e- |
| B、已知S-S键的键能为265kJ/mol,若使1mol某硫单质(气态)全部形成气态硫原子需要2120kJ能量,则3.2g这种硫单质中含S-S键的数目为0.1NA |
| C、0.1mol/L的FeBr3溶液中含0.3NA Br- |
| D、已知25℃,101kPa时气体摩尔体积为24.5L/mol.则此条件下0.05NA Fe与足量盐酸反应,产生H2约为1.225L |
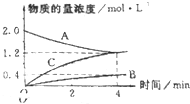 如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:
如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答: