题目内容
某元素原子的价电子构型是3s23p4,则它在周期表中的位置是( )
| A、第四周期ⅡA族 |
| B、第三周期ⅣA族 |
| C、第三周期ⅥA族 |
| D、第二周期ⅣA族 |
考点:原子核外电子排布,元素周期表的结构及其应用
专题:原子组成与结构专题
分析:根据核外电子排布确定原子结构特点,可确定元素在周期表中的位置.
解答:
解:某元素的原子的价电子构型是3s23p4,它在周期表中的位置是第三周期ⅥA族,故选:C.
点评:本题考查原子结构与位置关系,题目难度不大,注意整体把握元素周期表,注意掌握原子核外电子的排布规律.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
分别将一小块钠投入下列溶液中,只有一种气体放出,没有沉淀生成的是( )
| A、饱和NaCl溶液 |
| B、稀NaHSO4溶液 |
| C、MgCl2溶液 |
| D、CuSO4溶液 |
对于可逆反应H2(g)+I2(g)?2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A、H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B、正、逆反应速率的比值是恒定的 |
| C、当HI的分子数与I2分子数之比为2:1时,说明反应达到了平衡状态 |
| D、达到平衡时,正、逆反应速率相等 |
下列变化中,能表明硝酸具有氧化性的是( )
| A、石蕊试剂变红色 |
| B、能跟Ag反应生成AgNO3 |
| C、碳酸钙反应 |
| D、能和FeO反应生成Fe(NO3)3 |
下列说法错误的是( )
| A、不同条件下,1mol任何气体所含分子个数均相同 |
| B、1mol任何气体的体积均为22.4L |
| C、1mol气体在压强一定时,50℃时体积比20℃时体积大 |
| D、1LO2和1LO3在同温同压下具有相同数目的分子 |
 元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.
元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.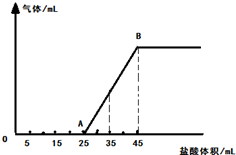 将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示: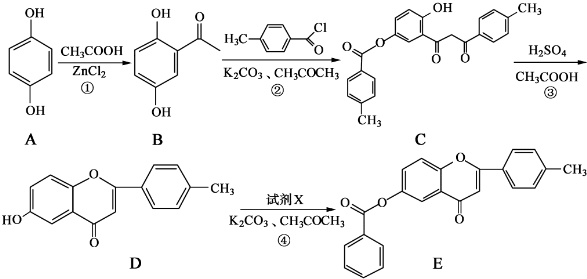

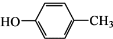 和CH3COOH为原料制备
和CH3COOH为原料制备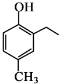 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: