题目内容
用如下图所示装置进行实验,将A逐滴加入B中:
(1)若A为浓硫酸;B为第3周期金属元素的片状单质,在常温下难与水反应;C为品红溶液。观察到品红溶液褪色,则B是_____________(写化学式),B与浓硫酸反应的化学方程式为____________________________。反应后向烧杯中加入沸水,又可观察到试管C中的现象是_____________________________________________________________________。
(2)若B为Na2CO3溶液,C为C6H5ONa溶液,实验中观察到小试管C内溶液由澄清变浑浊,则酸A应具有的性质是__________,然后向烧杯中加入沸水,可观察到试管C中的现象是_____________________________________________________________________。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解。当沉淀恰好完变溶解变为澄清溶液时,关闭E,然后向烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是__________(填名称),C是__________(填化学式)与葡萄糖混合溶液反应,该反应的离子方程式为__________,仪器D在此实验中的作用是_______________________________。
解析:本题为一实验综合题,考查了常见重要的无机和有机实验。试题设计比较新颖,且知识跨度较大,(1)中只要能抓住第3周期片状单质金属,在常温下难与水反应,即可顺利解答;但不可错认为常温下难与浓硫酸反应。(2)主要考查常见酸的酸性强弱规律。(3)中信息点是银镜,只要抓住这一点,便能较容易地想到银氨溶液。
答案:(1)Mg Mg+2H2SO4(浓)![]() MgSO4+SO2↑+2H2O 溶液又变红色
MgSO4+SO2↑+2H2O 溶液又变红色
(2)酸性比碳酸的酸性强 溶液由浑浊变澄清
(3)氨水 AgNO3 CH2OH(CHOH)4CHO+2[Ag(NH3)2]++2OH-![]() CH2OH(CHOH)4COO- +
CH2OH(CHOH)4COO- +![]() +H2O+2Ag+3NH3↑ 防止倒吸。
+H2O+2Ag+3NH3↑ 防止倒吸。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?(填“合理”或“不合理”)__________。简要说明理由___________________________________________。
(3)该同学无法确定反应中是否有氧气生成,拟用如下图所示装置进行实验。
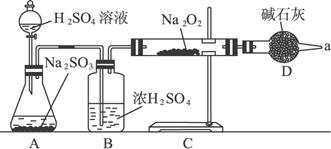
装置B的作用是_________________________________________________。D的作用是:________________________________________。
(4)为确认反应产物,请完成下表中所列实验
操作 | 现象与结论 |
①确认是否有氧气产生的操作是: |
|
②确认是否有硫酸钠产生的操作是: |
|
用如下图所示装置进行下列实验,实验结果与预测的现象不一致的是
|
|
①中的物质 |
②中的物质 |
预测①的现象 |
|
A |
淀粉KI溶液 |
浓硝酸 |
无明显现象 |
|
B |
酚酞溶液 |
浓盐酸 |
无明显现象 |
|
C |
AlCl3溶液 |
浓氨水 |
有白色沉淀 |
|
D |
湿润红纸条 |
饱和氯水 |
红纸条褪色 |



