题目内容
(1)写出CO2与Na2O2反应的化学方程式:______________________________。(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?(填“合理”或“不合理”)__________。简要说明理由___________________________________________。
(3)该同学无法确定反应中是否有氧气生成,拟用如下图所示装置进行实验。
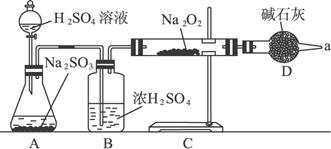
装置B的作用是_________________________________________________。D的作用是:________________________________________。
(4)为确认反应产物,请完成下表中所列实验
操作 | 现象与结论 |
①确认是否有氧气产生的操作是: |
|
②确认是否有硫酸钠产生的操作是: |
|
解析:本题中CO2与Na2O2反应这一主干知识,延伸为SO2与Na2O2反应产物的判断与检验。SO2与CO2相比较两者共同之处在于均为酸性氧化物,不同之处在于SO2具有较强的还原性。所以SO2与Na2O2的反应与CO2与Na2O2的反应应有相似之处又存在区别。在反应过程中,由于Na2O2的强氧化性,S元素的化合价应由+4价升高到+6价,反应产物中可能会生成O2。O2的检验可利用其特征检验法:能使带火星的木条复燃。
答案:
(1)2Na2O2+2CO2====2Na2CO3+O2
(2)合理 因为Na2O2有强氧化性,SO2有还原性
(3)干燥SO2 吸收多余SO2,防止空气进入C中,从而使Na2O2与空气中的水分和CO2反应
(4)
操作 | 现象与结论 |
①将带火星木条接近a口木条复燃,证明有O2生成 | 木条不复燃,证明无O2生成 |
②将C中固体溶入稀HCl后再加入BaCl2溶液 | 有沉淀产生,证明有Na2SO4生成无沉淀产生,证明无Na2SO4生成 |

(10分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
|
化学键 |
Cl-Cl |
H—H |
H—Cl |
N≡N |
|
键能/kJ·mol |
243 |
436 |
431 |
946 |
(1)按要求完成填空
a 2HCl(g) = H2(g)+Cl2(g);△H=
b N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是 kJ·mol
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式

(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l)ΔH = (用含ΔH1、ΔH2、ΔH3的式子表示)
(4) 已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H= -815.88 kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式_______________________。
 (2013?淄博二模)(1)写出Co2+离子基态的价电子排布式:
(2013?淄博二模)(1)写出Co2+离子基态的价电子排布式: 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).





