题目内容
16.把a mol C2H4跟b mol H2在密闭容器中,在适当条件下,反应达到平衡时生成了p mol C2H6,若将所得平衡混合气体混合气体,生成CO2和H2O,所需氧气的物质的量应是( )| A. | (3a+0.5b)mol | B. | (3a+0.5b)mol | C. | (3a+0.5b+3p)mol | D. | (3a+0.5b-3p)mol |
分析 根据元素守恒,反应后混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,反应物为CO2和H2O,根据质量守恒可计算出最终消耗的氧气.
解答 解:反应前后C和H反应后元素的质量没有发生变化,则混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,
原混合物中含有C的物质的量为2amol,H的物质的量为4amol+2bmol,
根据反应物为CO2和H2O,1molC消耗1mol氧气,1molH消耗$\frac{1}{4}$mol氧气,
则消耗的氧气的物质的量为:2amol+$\frac{4}{4}$amol+$\frac{2}{4}$=(3a+0.5b)mol,
故选A.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意反应后混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,根据1molC消耗1mol氧气,1molH消耗$\frac{1}{4}$mol氧气计算.

练习册系列答案
相关题目
4.短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
(1)XY2的电子式是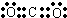 ;
;
Z2Y2中所含化学键类型是离子键和非极性共价键;(极性键、非极性键、离子键)
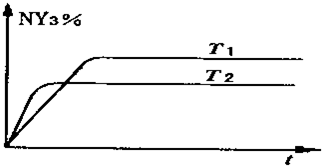
(2)①恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g)?2NY3(g).
温度分别为T1和T2时,NY3的体积分数随时间变化如图,该反应的△H<0(填“>”“<”或“=”,下同)若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1>K2.
②恒压条件下,在该容器中充入惰性气体v(NY2)将减小(填增大或减小)
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
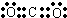 ;
;Z2Y2中所含化学键类型是离子键和非极性共价键;(极性键、非极性键、离子键)
(2)①恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g)?2NY3(g).
温度分别为T1和T2时,NY3的体积分数随时间变化如图,该反应的△H<0(填“>”“<”或“=”,下同)若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1>K2.

②恒压条件下,在该容器中充入惰性气体v(NY2)将减小(填增大或减小)
11.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )

| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 该温度下HClO2的电离平衡常数的数值Ka≈1.0×10-6 | |
| D. | 不同pH的NaClO2溶液中存在下列关系:c( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) |
8.下列各组元素的原子序数中,其相应的元素原子能形成X2Y共价化合物的是( )
| A. | 11与16 | B. | 1与8 | C. | 12与17 | D. | 6与8 |
5.以石油为原料生产简单化工产品,下列说法正确的是( )
石油$\stackrel{①}{→}$分馏产品$\stackrel{②}{→}$乙烯$\stackrel{③}{→}$CH2BrCH2Br.
石油$\stackrel{①}{→}$分馏产品$\stackrel{②}{→}$乙烯$\stackrel{③}{→}$CH2BrCH2Br.
| A. | ①②过程中都只发生了物理变化 | |
| B. | 石油主要是由各种烷烃、环烷烃、芳香烃组成的混合物 | |
| C. | 石油的分馏产品中不能得到汽油、柴油 | |
| D. | ③是加成反应,产物名称是1,2-溴乙烷 |

 (或
(或
 ).
).
 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;.