题目内容
3.2003年11月《环球时报》美国特约记用者文章:一种名为苹果醋(ACV)的浓缩饮料多年来风靡美国.ACV是一种由苹果发酵而成的酸性饮品,是具有明显药效的健康食品,有解毒、降脂、减肥和止泻功能.苹果酸是这种饮料的主要酸性物质.分离提纯后的化学分析如下:(1)元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为:24:3:40;该酸蒸气的密度是同温同压下氢气密度的67倍.
(2)0.l mol该酸与足量NaHCO3反应放出4.48L CO2,与足量金属Na反应放出3.36L H2(气体体积均已折算为标准状况下的体积).
(3)*该酸分子结构中没有支链.
请回答下列问题:
(1)该酸的分子式为C4H6O5,结构简式为
 .
.(2)写出该酸在一定条件下分子内脱水生成不饱和脂肪酸的反应化学方程式
 $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O.
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O.(3)写出该酸在一定条件下,每两个分子发生分子间脱水生成环酯的所有结构简式:
 、
、 、
、 .
.
分析 该酸中C、H、O的质量比为24:3:40,原子个数比为:$\frac{24}{12}$:$\frac{3}{1}$:$\frac{40}{16}$=4:6:5,其最简式为C4H6O5,该酸蒸气的密度是同温同压下氢气密度的67倍,相对分子质量为:67×2=134,由于最简式C4H6O5的式量为:12×4+6+16×5=134,则该酸分子式为:C4H6O5;0.lmol该酸与足量NaHCO3反应放出4.48L CO2,二氧化碳的物质的量为:$\frac{44.8L}{22.4L/mol}$=0.2mol,说明该酸分子中含有两个羧基;0.1mol该酸与足量金属Na反应放出3.36LH2,氢气的物质的量为:$\frac{33.6L}{22.4L/mol}$=0.15mol,说明该酸中含有2个羧基外,还应该含有1个羟基,又由于其分子中不含支链,则该酸的结构简式为: ,据此进行解答.
,据此进行解答.
解答 解:该酸中C、H、O的质量比为24:3:40,原子个数比为:$\frac{24}{12}$:$\frac{3}{1}$:$\frac{40}{16}$=4:6:5,其最简式为C4H6O5,该酸蒸气的密度是同温同压下氢气密度的67倍,相对分子质量为:67×2=134,由于最简式C4H6O5的式量为:12×4+6+16×5=134,则该酸分子式为:C4H6O5;0.lmol该酸与足量NaHCO3反应放出4.48L CO2,二氧化碳的物质的量为:$\frac{44.8L}{22.4L/mol}$=0.2mol,说明该酸分子中含有两个羧基;0.1mol该酸与足量金属Na反应放出3.36LH2,氢气的物质的量为:$\frac{33.6L}{22.4L/mol}$=0.15mol,说明该酸中含有2个羧基外,还应该含有1个羟基,又由于其分子中不含支链,则该酸的结构简式为: ,
,
(1)由以上分析可知酸的分子式为C4H6O5,结构简式为,故答案为:C4H6O5; ;
;
(2) 分子中含有羧基和羟基,在一定条件下分子内脱水生成不饱和脂肪酸:HOOCCH=CHCOOH,该反应化学方程式为:
分子中含有羧基和羟基,在一定条件下分子内脱水生成不饱和脂肪酸:HOOCCH=CHCOOH,该反应化学方程式为: $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O,
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O,
故答案为: $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O;
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O;
(3) 分子中含有两个羧基、1个羟基,在一定条件下每两个分子发生分子间脱水生成环酯,生成产物的结构简式有:
分子中含有两个羧基、1个羟基,在一定条件下每两个分子发生分子间脱水生成环酯,生成产物的结构简式有: 、
、 、
、 ,
,
故答案为: 、
、 、
、 .
.
点评 本题考查有机推断,题目难度中等,注意熟练掌握常见有机物结构与性质,根据题中信息确定该酸的分子式、结构简式为解答关键,试题侧重考查学生达到分析、理解能力及灵活应用基础知识的能力;(3)为难点,注意正确书写两分子该酸生成环酯的结构简式.

 阅读快车系列答案
阅读快车系列答案| A. | 2H2S+SO2═3S+2H2O | B. | Fe+Cu2+═Fe2++Cu | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
| A. | FeS2中的硫元素全部被氧化 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 产物中SO42-有一部分是氧化产物 | |
| D. | FeS2只用作还原剂 |
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.
| A. | 1mol NH4CuSO3完全反应转移0.5mol电子 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 反应中硫酸作氧化剂 |
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)配制0.50mol/L NaOH溶液必须用到的仪器有:天平(带砝码)、烧杯、玻璃棒、250ml容量瓶和胶头滴管.
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示.
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和环形玻璃搅拌棒.泡沫塑料的作用是减少实验过程中的热量损失.
(2)写出该反应的热化学方程式(中和热△H=-57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
| 实验次数] | 起始温度t1/°C] | 终止温度t2/°C] | 温度差平均值(t2-t1)/°C] | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与-57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.

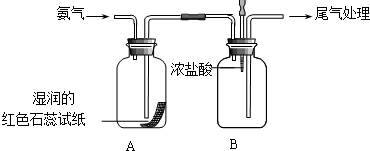 某小组同学利用如图所示装置探究氨气的性质.
某小组同学利用如图所示装置探究氨气的性质. 工业电解饱和食盐水模拟装置的结构如图所示:
工业电解饱和食盐水模拟装置的结构如图所示: .
.