题目内容
13. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)配制0.50mol/L NaOH溶液必须用到的仪器有:天平(带砝码)、烧杯、玻璃棒、250ml容量瓶和胶头滴管.
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示.
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和环形玻璃搅拌棒.泡沫塑料的作用是减少实验过程中的热量损失.
(2)写出该反应的热化学方程式(中和热△H=-57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
| 实验次数] | 起始温度t1/°C] | 终止温度t2/°C] | 温度差平均值(t2-t1)/°C] | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与-57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
分析 Ⅰ、(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
(2)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
Ⅱ、(1)根据量热计的构造来判断该装置的缺少仪器;中和热测定实验成败的关键是保温工作;
(2)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(3)①先判断温度差的有效性,然后求出温度差平均值;
②根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
③a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,测得的热量偏小;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高.
解答 解:Ⅰ、(1)没有245mL的容量瓶,所以用250mL的容量瓶,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,故答案为:5.0;
(2)一般用托盘天平称量溶质,在烧杯中溶解溶质氢氧化钠并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管.根据提供的仪器可知,还需仪器是250ml容量瓶、胶头滴管,
故答案为:250ml容量瓶、胶头滴管;
Ⅱ.(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满泡沫塑料的作用是减少实验过程中的热量损失;
故答案为:环形玻璃搅拌棒;减少实验过程中的热量损失;
(2)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和稀氢氧化钠反应的中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(3)①4次温度差分别为:4.0℃,4.0℃,3.9℃,4.1℃,均有效,温度差平均值4.0℃,
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80mL×1g/cm3=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-$\frac{1.3376kJ}{0.025mol}$=-53.5kJ/mol,
故答案为:-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd.
点评 本题考查热化学方程式以及反应热的计算,题目难度不大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

| A. | AgCl为电池的正极 | |
| B. | 正极反应为Ag++e-=Ag | |
| C. | 该电池一定不能被MgCl2溶液激活 | |
| D. | 可用于海上应急照明供电,直接将化学能转化为光能 |
| A. | 18g水所含分子数目为NA,体积约为24.5L | |
| B. | 0.1mol•L-1的NaNO3溶液中含有0.1NA个NO3- | |
| C. | 1mol Fe与足量的盐酸反应,转移3NA个电子 | |
| D. | 2.3g钠离子所含电子数目为1NA |

| A. | 在上述三步反应中理论上只有①生成②的反应原子利用率为100% | |
| B. | 氯化铁溶液和碳酸氢钠溶液都能鉴别①④ | |
| C. | ②③分子内含手性碳原子 | |
| D. | 在氢氧化钠溶液中,等物质的量的①和③分别消耗NaOH物质的量之比为1:2 |
 .
. 、
、 、
、 .
.
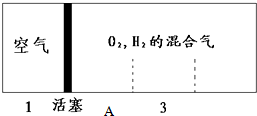 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.