题目内容
6.下列物质中的硫元素,只具有还原性而不具有氧化性的是( )| A. | H2S | B. | SO2 | C. | H2SO3 | D. | H2SO4 |
分析 由元素的化合价可知,处于最高价的元素的微粒具有氧化性,处于最低价的元素的微粒具有还原性,而处于中间价态的微粒既有氧化性又有还原性,以此来解答.
解答 解:S元素的化合价有-2、0+4、+6价,其中0、+4价处于中间价态,既具有氧化性也具有还原性,+6价处于最高价态,只具有氧化性,-2价的化合物只有还原性,则只有还原性的为H2S,
故选A.
点评 本题考查氧化还原反应及微粒的性质,为高频考点,明确氧化性、还原性与微粒中元素的化合价的关系是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
5.下列化学用语表达不正确的是( )
| A. | 氨分子的电子式: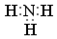 | B. | CO2分子的结构式:O=C=O | ||
| C. | S2-的离子结构示意图: | D. | 苯分子的结构简式: |
17.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为NA | |
| B. | 常温下,2.7g铝与足量盐酸反应,失去电子数为0.3NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为$\frac{1}{22.4}$NA |
14.以下物质间的转化通过一步反应不能实现的是( )
| A. | Na---Na2O2---Na2CO3---NaHCO3 | B. | Fe---Fe3O4---FeCl2---Fe(OH)3 | ||
| C. | Si---SiO2---H2SiO3---Na2SiO3 | D. | S---SO2---SO3--H2SO4 |
1.一定温度下,用水吸收SO2气体,若得到pH=5的饱和H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比约为(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-7mol/L)( )
| A. | 50:3 | B. | 100:3 | C. | 50:6 | D. | 500:3 |
11. 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- | |
| D. | 充电时,AlCl4-向石墨电极方向移动 |
18.纯碱在玻璃、肥皂、造纸、食品等工业中有广泛的应用,纯碱属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
15.下列关于铁及其化合物的说法不正确的是( )
| A. | 炼铁原料有铁矿石、焦炭、空气和石灰石 | |
| B. | FeCl3溶液能使KI淀粉溶液变蓝色 | |
| C. | 灼热的铁丝放入盛有干燥氯气的集气瓶中燃烧生成棕色的烟雾 | |
| D. | 利用Cu与FeCl3溶液的反应制作印刷电路板 |